
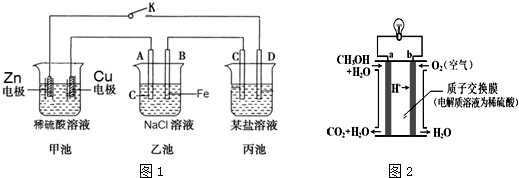
分析 (1)多池串连,活泼性强的电极所在的池为原电池,其它池都是电解池;
(2)甲池中铜为正极,锌为负极;
(3)乙池中铁为阴极,水中的氢离子放电生成氢氧根离子,所以Fe附近的现象是酚酞溶液变红,乙池中反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(4)利用此装置在一铁器上面镀铜则电极材料,则镀层金属为阳极,即C为铜,镀件为阴极,选用含有镀层金属阳离子的盐为电解质溶液;
(5)a是通燃料的电极,是负极发生氧化反应,电极的电极反应式是电极反应式为:CH3OH+H2O-6e-=CO2+6H+.
解答 解:(1)多池串连,活泼性强的电极所在的池为原电池,其它池都是电解池,甲池为原电池,乙池是电解池,故答案为:电解池;
(2)甲池中铜为正极,锌为负极,故答案为:正极;
(3)乙池中铁为阴极,水中的氢离子放电生成氢氧根离子,所以Fe附近的现象是酚酞溶液变红,乙池中反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:溶液变红;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(4)利用此装置在一铁器上面镀铜则电极材料,则镀层金属为阳极,即C为铜,镀件为阴极,选用含有镀层金属阳离子的盐为电解质溶液,故答案为:铜;
(5)a是通燃料的电极,是负极发生氧化反应,电极的电极反应式是电极反应式为:CH3OH+H2O-6e-=CO2+6H+,故答案为:CH3OH+H2O-6e-=CO2+6H+.
点评 本题考查了电化学知识点,根据电镀镀层金属为阳极,镀件为阴极,选用含有镀层金属阳离子的盐为电解质溶液,离子的放电顺序来分析解答,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
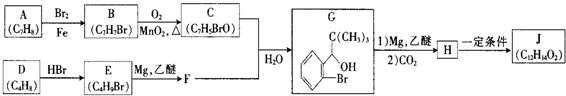
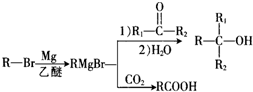
 .
. +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$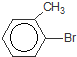 +HBr,反应类型为取代反应.
+HBr,反应类型为取代反应.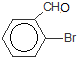 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O. .
. 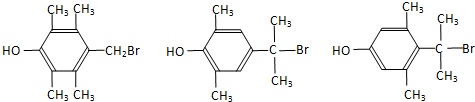 任意2种.
任意2种.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
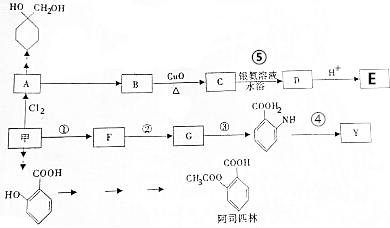
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ (苯胺,易被氧化);
(苯胺,易被氧化); ,最多有13个原子共面.
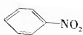
,最多有13个原子共面. 的名称为邻羟基苯甲酸,G中官能团名称为羧基、硝基.
的名称为邻羟基苯甲酸,G中官能团名称为羧基、硝基. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 项目 | 二氯苯 | 尾气 | 不确定苯耗 | 流失总量 |
| 苯流失量(kg/t) | 13 | 24.9 | 51.3 | 89.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
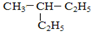 和
和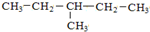
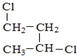 与
与 ④H2O和D2O
④H2O和D2O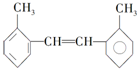 其苯环上的一氯代物有4种;1mol该物质和溴水混合,消耗Br2的物质的量为1mol.
其苯环上的一氯代物有4种;1mol该物质和溴水混合,消耗Br2的物质的量为1mol.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
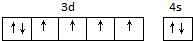 .
. ,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.
,该吸附方式能加快反应速率的原因是氮氮三键变成了双键,结构发生改变.| X射线衍射 | N-H键长 | N-N距离 | H-N-H键角 |
| 数据 | 101.9pm | 339.0pm | 107° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60s内以X浓度变化表示的反应速率为0.001 mol/(L•s) | |
| B. | 将容器体积变为20L,Z的平衡浓度变为原来的$\frac{1}{2}$ | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的正反应为吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com