
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | 金属钠和水的反应:Na+2H2O=H2↑+Na++2OH- | |
| C. | Al(OH)3沉淀中滴加盐酸:Al(OH)3+3H+=Al3++3H2O | |
| D. | Ba(OH)2溶液中加入稀H2SO4:Ba2++SO42-=BaSO4↓ |
分析 A.反应生成氯化铁,电荷、电子不守恒;
B.电荷、电子不守恒;
C.反应生成氯化铝和水;
D.漏写生成水的离子反应.
解答 解:A.FeCl2溶液中通入Cl2的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.金属钠和水的反应的离子反应为2Na+2H2O=H2↑+2Na++2OH-,故B错误;
C.Al(OH)3沉淀中滴加盐酸的离子反应为Al(OH)3+3H+=Al3++3H2O,故C正确;
D.Ba(OH)2溶液中加入稀H2SO4的离子反应为2H++2OH-+Ba2++SO42-=BaSO4↓+2H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应及复分解反应的离子反应考查,注意电子、电荷守恒及离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:解答题
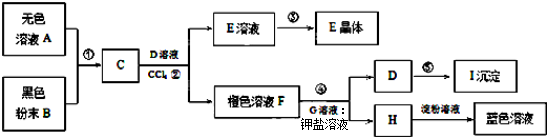
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠在氯气中燃烧制氯化钠 | B. | 氢气和氯气混合经光照制氯化氢 | ||
| C. | 氯气通入澄清石灰水中制漂白粉 | D. | 高温分解石灰石制生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
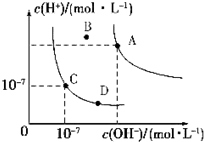
| A. | 水的离子积常数关系为:KW(B)>KW(A)>KW(C)>KW(D) | |
| B. | B点对应的温度下,pH=4的硫酸与pH=10的氢氧化钠溶液等体积混合,溶液的pH=7 | |
| C. | 向水中加入醋酸钠固体,可从C点到D点 | |
| D. | 升高温度可实现由C点到D点 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
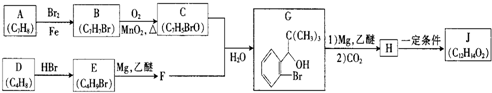
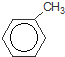 +Br2$\stackrel{铁粉}{→}$
+Br2$\stackrel{铁粉}{→}$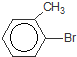 +HBr,其反应类型为取代反应
+HBr,其反应类型为取代反应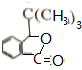
 .
.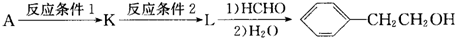
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40 K和40 Ca原子中的质子数和中子数都相等 | |
| B. | 某元素最外层只有一个电子,则它一定是ⅠA族元素 | |
| C. | 任何原子或离子的组成中都含有质子 | |
| D. | 同位素的不同核素物理、化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ③④⑤⑦ | C. | ④⑤⑥ | D. | ④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
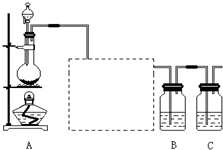 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铅蓄电池电池是一次电池 | |
| B. | 负极反应式为Pb-2e-═Pb2+ | |
| C. | 连续工作后电解液的酸性将减小 | |
| D. | 工作中,每转移0.2 mol电子时,负极质量减少6.5 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com