
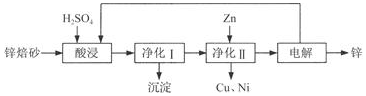
���� ��п��ɰ����Ҫ��ZnO��ZnFe2O4������������CaO��FeO��CuO��NiO������������������ӦCaO+H2SO4=CaSO4+H2O�����������ˮ����ZnFe2O4+8H+=Zn2++2Fe3++4H2O��ZnO+2H+=Zn2++H2O��FeO+2H+=Fe2++H2O��CuO+2H+=Cu2++H2O��NiO+2H+=Ni2++H2O������Һ�м���˫��ˮ��������Ӧ2Fe2++2H++H2O2=2 Fe3++2H2O��������Һ��pH��Fe3+ת��ΪFe��OH��3������������ҺpHʱ���������µ����ʣ�������ZnO��Ȼ������Һ�м���Zn�������û���ͭ������Ȼ����ˣ������õ�Zn���Դ˽����⣮
��� �⣺��1�����ʱZnFe2O4������ѧ����ʽΪ��ZnFe2O4+4H2SO4�TZnSO4+Fe2��SO4��3+4H2O�����������Σ��������ηֱ�Ϊ����п����������
�ʴ�Ϊ������п����������
��2���ټ��������������������������������ӣ�����������װ�ã�Ӧ����H2O2���ʴ�Ϊ��b��
���������ɵ�Fe��OH��3���壨���������������ԣ����Ծ��������ɵij����л�������Һ�е��������ʣ�
�ʴ�Ϊ��Fe��OH��3���壨���������������ԣ�
��3������Һ�м���Zn�������û���ͭ��������Ӧ�����ӷ���ʽΪCu2++Zn=Cu+Zn2+��Ni2++Zn=Ni+Zn2+��
�ʴ�Ϊ��Cu2++Zn=Cu+Zn2+��Ni2++Zn=Ni+Zn2+��
��4��ͨ����ȡ����п������ͼʾ����֪��������ѭ�����õ����ʳ�п�⣬�������ᡢ����п���������п��Һ�������ᡢп����������ⷽ��ʽΪ2ZnSO4+2H2O$\frac{\underline{\;���\;}}{\;}$2H2SO4+2Zn+O2����
�ʴ�Ϊ��H2SO4��ZnSO4��2ZnSO4+2H2O$\frac{\underline{\;���\;}}{\;}$2H2SO4+2Zn+O2����
���� �����ۺϿ������ʵ��Ʊ��Լ����룬Ϊ�߿��������ͣ���Ŀ������ȡ����п�����̿��������ӷ���ʽ����ѧ����ʽ����д��֪ʶ��ע���������������Ϣ�������Ѷ��еȣ���ֿ����˷���������������


 �������Ͽ��㱾ϵ�д�
�������Ͽ��㱾ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
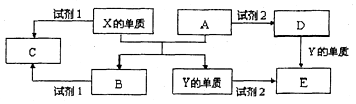 A��B��C��D��E����ѧ������5�ֻ����A��B�������Ԫ��X��Y�ĵ����������г����Ľ�����������ʼ�Ĺ�ϵ��ͼ��ʾ��
A��B��C��D��E����ѧ������5�ֻ����A��B�������Ԫ��X��Y�ĵ����������г����Ľ�����������ʼ�Ĺ�ϵ��ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2 mol FeSO4������Ӧʱ����Ӧ�й���10 mol����ת�� | |
| B�� | ÿ����16g��������1molFe2+����ԭ | |
| C�� | Na2O2ֻ�������� | |
| D�� | ��������ֻ��Na2FeO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���������������ԭ�ӱ���ԭ��ȡ���������ֲ�ͬ�ṹ���� | |
| B�� | ��ȩ��ʹ�����ʱ��ԣ�������ʳƷ������ | |
| C�� | �״�������ˮ����֮����������ʹ�״���ˮ����������ǿ | |
| D�� | �ױ��뱽��Ϊͬϵ�����ʹKMnO4������Һ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������е�������ƫ��������Һ��AlO2-+H++H2O=Al��OH��3�� | |
| B�� | ��NaClO��Һ��ͨ������SO2��2ClO-+SO2+H2O�T2HClO+SO32- | |
| C�� | Cl2ͨ��ˮ�У�Cl2+H2O�T2H++Cl-+ClO- | |
| D�� | �ù�����ˮ���չ�ҵβ���е�SO2��2NH3•H2O+SO2�T2NH4++SO32-+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��C��ʯī��=C�����ʯ����H=1.9kJ•mol-1����֪���ʯ��ʯī���ȶ� | |
| B�� | ���������������������ֱ���ȫȼ�գ����߷ų��������� | |
| C�� | ��H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ•mol-1������0.1mol/L�������м���4.0 gNaOH���壬�ų���������5.73 kJ | |
| D�� | 2 gH2��ȫȼ������Һ̬ˮ�ų�285.8 kJ������������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g��=2H2O��l����H=-571.6 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 L 0.1 mol/L��NaHSO3��Һ�к�HSO3-����ĿΪ0.1NA | |
| B�� | ��֪2SO2��g��+O2��g��?2SO3��g����H=-196.6 kJ/mol����1 mol SO2������O2��Ϻ��ַ�Ӧ�ų�������Ϊ98.3 kJ | |
| C�� | ���Ե缫�������ͭ����Һ������������6.4 gͭʱ�����������������ڱ�״����Ϊ1.12 L | |
| D�� | ��������������ʴʱ������1 mol O2��ת�Ƶ�����Ϊ4NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
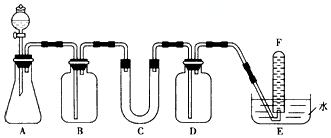
| ���� | �����Լ� | �����Լ���Ŀ�� |
| B | ����NaHCO3��Һ | |
| D | ���չ���CO2 | |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com