
 氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.
氯元素可以形成HClO、HClO2、HClO3、HClO4多种含氧酸.分析 (1)化合物中正负化合价代数和为0,NaClO2溶液中Kh=$\frac{Kw}{Ka}$;
(2)由反应物、生成物书写化学反应,HClO3不稳定;
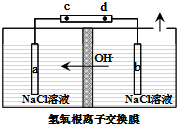
(3)由图可知,OH-向a移动,则a为阳极,c为电源的正极,阳极氯离子失去电子生成ClO3-;结合电子守恒计算溶液质量,结合溶解度差异分离出产品.
解答 解:(1)化合物中正负化合价代数和为0,HClO2中Cl元素的化合价是0-1-(-2)×2=+3;已知常温下HClO2的电离常数Ka=1.0×10-2,NaClO2溶液中Kh=$\frac{Kw}{Ka}$,则1.0mol•L-1NaClO2溶液的c2(OH-)=$\frac{1{0}^{-14}}{1{0}^{-2}}$×1mol/L,c(OH-)=10-6mol/L,可知c(H+)=10-8mol/L,pH 约为8,
故答案为:+3;8;
(2)Ba(ClO3)2溶液稀硫酸反应制HClO3溶液,还生成硫酸钡,其反应的化学方程式为Ba(ClO3)2+H2SO4═BaSO4↓+2HClO3;将反应后溶液在减压下浓缩可得到30%的HClO3溶液,选择减压浓缩的可能原因是防止HClO3分解,
故答案为:Ba(ClO3)2+H2SO4═BaSO4↓+2HClO3;防止HClO3分解;
(3)①由图可知,OH-向a移动,则a为阳极;电解过程中产生ClO3-的电极反应式为Cl-+6OH--6e-=ClO3-+3H2O,
故答案为:阳极;Cl-+6OH--6e-=ClO3-+3H2O;
②氢氧根离子移向左侧,右侧氢离子放电,则减少的质量为水的质量,当电路上转移0.6mol 电子时,由H2O~e-~H+,交换膜右侧电解质溶液质量减少0.6mol×18g/mol=10.8g,故答案为:10.8;
③电解一段时间后,将电解液与KCl溶液混合即可反应析出KClO3晶体,经过蒸发浓缩、冷却结晶、干燥即可获得KClO3晶体粗品,故答案为:蒸发浓缩;冷却结晶.
点评 本题考查弱电解质的电离常数应用、电解原理制备物质的应用,为高频考点,把握Kw、Ka、Kh的关系及电解原理等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
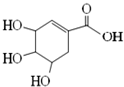
| A. | 分子式为C7H8O5 | |
| B. | 分子中含有2种官能团,可发生加成、酯化反应 | |
| C. | 其同分异构体中可能含酯基和醛基,不可能含有苯环 | |
| D. | 该化合物与足量的 Na、NaOH反应得到的钠盐产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)
;比较C和D的稳定性的强弱大小H2O>NH3(用化学式表示)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
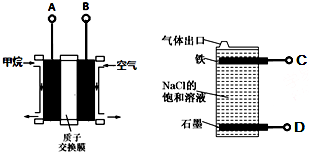
| A. | 燃料电池的A极连接电解池的C极 | |
| B. | 燃料电池工作时当0.2 NA个H+通过质子交换膜移向右边,饱和食盐水中可产生2.24L气体 | |
| C. | A电极的电极反应式为:CH4-8e-+2H2O═CO2+8H+ | |
| D. | 电解池总反应式为NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
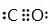 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.
,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于分子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水使有色布条褪色 | B. | 过氧化钠使某些染料褪色 | ||
| C. | 二氧化硫使品红溶液褪色 | D. | 活性炭使红墨水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| B. | 最外层电子数相同的元素一定属于同一族 | |
| C. | 非金属元素的最外层电子数都大于或等于4 | |
| D. | 同周期元素的电子层数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com