
 已知短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W.A是短周期中原子半径最大的元素.常温下X、Z,W均可与Y反应,A、C、D的原子序数及0.1 mol/LX、Z、W溶液的pH如图所示.下列说法正确的是( )
已知短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W.A是短周期中原子半径最大的元素.常温下X、Z,W均可与Y反应,A、C、D的原子序数及0.1 mol/LX、Z、W溶液的pH如图所示.下列说法正确的是( )| A. | B和D形成的化合物和W具有相同的化学键类型与晶体类型 | |
| B. | C氢化物稳定性大于D氢化物稳定性,而其水溶液的酸性D大于C | |
| C. | B与C所形成的化合物既可以由B、C的单质相互反应制得,也可由含B、C元素简单离子的盐溶液相互反应制得 | |
| D. | A、B、C、D四种元素均在第三周期,而其原子半径依次增大,对应简单离子的半径依次减小 |
分析 短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W.A是短周期中原子半径最大的元素,则A为Na元素,则X为NaOH;0.1 mol/L的W溶液pH=1,则W为一元含氧酸,且D的原子序数大于Na元素,则D为Cl元素、W为HClO4;0.1 mol/L的Z溶液pH=0.7,则氢离子浓度为10-0.7mol/L=0.2mol/L,故Z为二元强酸,且C的原子序数大于Na元素,则C为S元素、Z为H2SO4;常温下X、Z、W均可与Y反应,则Y为两性氢氧化物,则Y为Al(OH)3、B为Al元素,以此解答该题.
解答 解:短周期元素A、B、C、D最高价氧化物对应水化物分别为X、Y、Z、W.A是短周期中原子半径最大的元素,则A为Na元素,则X为NaOH;0.1 mol/L的W溶液pH=1,则W为一元含氧酸,且D的原子序数大于Na元素,则D为Cl元素、W为HClO4;0.1 mol/L的Z溶液pH=0.7,则氢离子浓度为10-0.7mol/L=0.2mol/L,故Z为二元强酸,且C的原子序数大于Na元素,则C为S元素、Z为H2SO4;常温下X、Z、W均可与Y反应,则Y为两性氢氧化物,则Y为Al(OH)3、B为Al元素,
A.B为Al元素,D为Cl元素,二者形成氯化铝,为共价化合物,W为HClO4,为共价化合物,故A正确;
B.非金属性S<Cl,则C氢化物稳定性小于D氢化物稳定性,故B错误;
C.B与C所形成的化合物为硫化铝,只能由单质生成,在溶液中对应的离子发生互促水解反应,故C错误;
D.A为Na元素,是短周期中原子半径最大的元素,故D错误.
故选A.
点评 本题考查结构性质位置关系应用、元素化合物推断、pH的有关计算等,侧重于学生的分析能力的考查,根据溶液pH值进行推断是关键,难度中等.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | 高空臭氧层吸收太阳紫外线,保护地球生物;反应3O2=2O3有单质参加,属于氧化还原反应 | |
| B. | 人造纤维,合成纤维和光导纤维都是有机高分子化合物 | |
| C. | 加热能杀死流感病毒是因为病毒的蛋白质受热变性 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M2+的离子半径比N3-小 | B. | M的原子序数比N小 | ||
| C. | M与N原子的电子层数相同 | D. | M与N的最外层电子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第三次月考化学卷(解析版) 题型:填空题
短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为 .
(2)已知:
①E﹣E→2E△H=+a kJ•mol﹣1;
②2A→A﹣A△H=﹣b kJ•mol﹣1;
③E+A→A﹣E△H=﹣c kJ•mol﹣1;
写出298K时,A2与E2反应的热化学方程式 .
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g)△H=﹣a kJ•mol﹣1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则A2的平均反应速率v(A2)= .
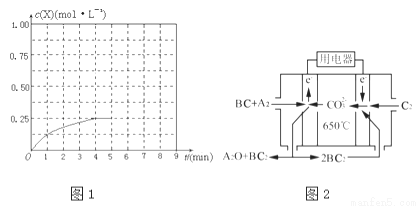
②计算该温度下此反应的平衡常数K= .
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
室温下,用0.1 mol·Lˉ 1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
1 NaOH溶液分别滴定体积均为20mL、浓度均为0.1 mol·Lˉ1 HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化如图,下列说法不正确的是
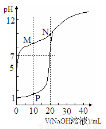
A.HX为弱酸
B.M点c(HX)-c(X-)﹥c(OH-)-c(H+)
C.将P点和N点的溶液混合,呈酸性
D.向N点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX) = c(Cl-) ﹥c(X-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
Ⅰ.按要求写出下列反应的热化学方程式:
(1)在25℃、101kPa下,1g甲醇液体燃烧生成C02和液态水时放热22.0kJ。则表示甲醇燃烧热的热化学方程式为__________________________。
(2)若适量的N2和02完全反应,每生成23g N02需要吸收16.0kJ热量,此反应的热化学方程式为___________________。
Ⅱ.对于下列三个反应,从正反开始进行达到平衡后,保持温度、体积 不变,按要求回答下列问题:
不变,按要求回答下列问题:
(1)PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
再充入PCl5(g),平衡向___________方向移动(填“正反应”或“逆反应”),达到平衡后,PCl5(g)的转化率___________(填“增大”、“减小”或“不变”,下同)。
(2)2HI(g) I2(g
I2(g )+H2(g)
)+H2(g)
再充入HI(g),平衡向___________方向移动,达到平衡后,HI的分解率___________。
(3)2NO2(g) N2O4(g)
N2O4(g)
再充入N2O4(g),平衡向___________方向移动,达到平衡后,NO2(g)的转化率___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com