
 按要求填空:
按要求填空:分析 (1)0.1mol CO2气体通入1L 0.2mol•L-1NaOH溶液中恰好反应生成碳酸钠,碳酸钠水解显碱性;能水解的盐促进水的电离,酸碱抑制水的电离;
(2)溶液混合得到等浓度的MOH、MCl混合溶液,混合溶液的pH<7,则说明在相同条件下MOH的电离程度小于MCl的水解程度;
(3)pH=3的HR溶液与pH=11的NaOH溶液,两种溶液中c(H+)=c(OH-),如HR为强酸,则反应后呈中性,如为弱酸,则反应后呈酸性;
(4)混合溶液中c(HCN)>c(CN-)说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,溶液中存在物料守恒和电荷守恒,据此分析解答;
(5)室温时,0.1mol/l某一元酸HA在水中的电离度为0.1%,溶液中C(H+)=0.1mol/L×0.1%=10-4mol/L,电离平衡常数K=$\frac{c({H}^{+}).c({A}^{-})}{c(HA)}$,升高温度促进HA电离;
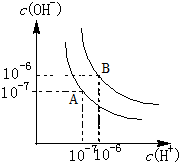
(6)Kw=C(H+).C(OH-),图象分析可知c(H+)=c(OH-)=10-6mol/L,
先根据水的离子积常数计算氢氧化钡溶液中C(OH-)、混合溶液中C(OH-),再根据$\frac{c(O{H}^{-})•V(Ba(OH)_{2})-c(H+)•V(HCl)}{V(Ba(OH)_{2})+V(HCl)}$计算氢氧化钡和盐酸的体积之比.
解答 解:(1)0.1mol CO2气体通入1L 0.2mol•L-1NaOH溶液中恰好反应生成碳酸钠,碳酸钠水解显碱性,其水解方程式为:CO32-+H2O?HCO3-+OH-;CO32-能水解,促进水的电离,NaOH抑制水的电离,所以合溶液中由水电离出的c(H+)>0.2mol•L-1NaOH溶液中由水电离出的c(H+);
故答案为:CO32-+H2O?HCO3-+OH-;>;
(2)常温下若将0.2mol•L-1MOH溶液与0.1mol•L-1HCl溶液等体积混合,溶液混合得到等浓度的MOH、MCl混合溶液,混合溶液的pH<7,则说明在相同条件下MOH的电离程度小于MCl的水解程度,
故答案为:<;
(3)pH=3的HR溶液与pH=11的NaOH溶液,两种溶液中c(H+)=c(OH-),如HR为强酸,则反应后呈中性,如为弱酸,则反应后呈酸性,已知混合溶液的pH≠7,则混合时HR过量,所以HR为弱酸,其电离方程式为HR?H++R-,
故答案为:HR?H++R-;
(4)混合溶液中c(HCN)>c(CN-)说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,则pH>7,
溶液中存在物料守恒,根据物料守恒得c(HCN)+c(CN-)=0.1mol/L,
故答案为:>;0.1;
(5)室温时,0.1mol/l某一元酸HA在水中的电离度为0.1%,溶液中C(H+)=0.1mol/L×0.1%=10-4mol/L,则该溶液的pH=4;
该温度时,电离平衡常数K=$\frac{c({H}^{+}).c({A}^{-})}{c(HA)}$=$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7;
故答案为:4;1×10-7;
(6)25℃时纯水中c(H+)=c(OH-)=10-7 mol/L,Kw=c(H+).c(OH-)=10-14 ,当温度升高到100℃,纯水中c(H+)=c(OH-)=10-6 mol/L,Kw=c(H+).c(OH-)=10-12 ;
将pH=8的Ba(OH)2溶液中c(OH-)=10-4 mol/L,pH=5的稀盐酸中c(H+)=10-5 mol/L,设氢氧化钡的体积为x,盐酸的体积为y,混合溶液的pH=7,溶液呈碱性,c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-7}}$=10-5 mol/L,c(OH-)=$\frac{1{0}^{-4}•x-1{0}^{-5}•y}{x+y}$=10-5 mol/L,x:y=2:9,
故答案为:1×10-12;2:9.
点评 本题考查了弱电解质的电离、盐的水解、离子积常数的有关计算,题目难度中等,根据电离平衡常数公式、pH公式、弱电解质电离影响因素等知识点解答即可.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表中有7个主族,7个副族 | |
| B. | VIA族元素原子的最外层电子数均为6 | |
| C. | 碳元素位于第二周期ⅣA族 | |
| D. | 氢分子中的化学键是极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族金属原子半径的大小 | |
| B. | 单质的熔沸点高低 | |
| C. | 与酸反应的剧烈程度 | |
| D. | 最高价氧化物对应水化物的碱性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
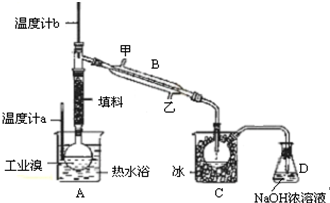
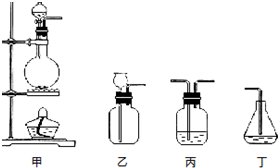
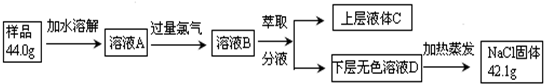
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com