
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电
电压,高铁电池的总反应为
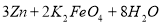

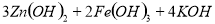
下列叙述不正确的是
A.充电时阳极反应为: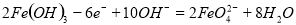
B.放电时负极反应为: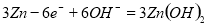
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(全国大纲卷解析版) 题型:选择题
已知:将Cl2通人适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且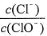 的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=amol时,下列有关说法错误的是
A.若某温度下,反应后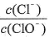 =11,则溶液中
=11,则溶液中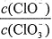 =
=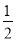
参加反应的氯气的物质的量等于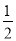 amol
amol
C.改变温度,反应中转移电子的物质的量ne的范围: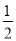 amol≤ne≤
amol≤ne≤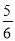 amol
amol
D.改变温度,产物中KC1O3的最大理论产量为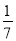 amol
amol
查看答案和解析>>
科目:高中化学 来源:2013年普通高等学校招生全国统一考试化学(广东卷解析版) 题型:选择题
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
| R |
|
X | T | Z |
| Q |
|
A.非金属性:Z<T<X
B.R与Q的电子数相差26
C.气态氢化物稳定性:R <T<Q
D.最高价氧化物的水化物的酸性:T>Q
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省原名校高三高考仿真模拟统一考试理综化学试卷(解析版) 题型:选择题
已知x、Y是元素周期表中前20号元素,二者原子序数相差3,x、Y能形成化台物M,下列说法正确的是
A.若X和Y处于同一周期,则X的原子半径肯定小于Y的原子半径
B.若X和Y处于不同的周期,则M溶于水所得溶液肯定呈碱性
C.若M属于离子化合物,则该化合物中只存在离子键
D.若M属于离子化台物,则该化合物中原子个数比可能为1:2
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:填空题
(9分) I:常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表
序号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
请回答:(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________ ___。
(用反应的离子方程式表示),在该溶液中下列关系式不正确的是(填序号字母)________。
A.c(Na+)+c(H+)=c(OH-)+c(A-) B.c(Na+)=c(HA)+c(A-)
C.c(HA)+c(H+)=c(OH-) D.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c __0.2mol·L-1(选填“>”、“<”或“=”)。混合溶液中离子浓度c(A-)________c(Na+)(选填“>”、“<”或“=”)
从③组实验结果分析,说明HA的电离程度________NaA的水解程度(选填“>”、“<”或“=”),离子浓度由大到小的顺序是______________________________________。
Ⅱ:室温下,若将0.1 mol·L-1盐酸滴入20 mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示。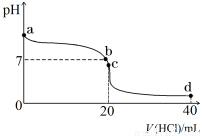
(1)NH3·H2O的电离方程式是 。
(2)b点所示溶液中的溶质是 。
(3)c点所示溶液中,离子浓度从大到小的关系为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
对于可逆反应A(g)+2B(g) 2C(g)(正反应吸热),下列图象中正确的是
2C(g)(正反应吸热),下列图象中正确的是
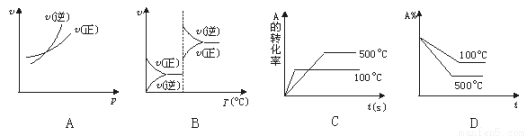
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市房山区下学期高二期末测验化学试卷(解析版) 题型:选择题
下列解释事实的反应方程式不正确的是
A.氨水使酚酞溶液变红: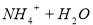

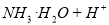
B.醋酸使碳酸钙溶【解析】
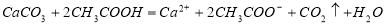
C.草酸溶液使高锰酸钾酸性溶液褪色: 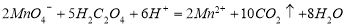
D.向污水中投放明矾,生成能凝聚悬浮物的胶体: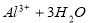

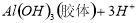
查看答案和解析>>
科目:高中化学 来源:2014秋季江西省赣州市十二县高一上学期期中联考化学试卷(解析版) 题型:选择题
设NA代表阿伏加德罗常数,下列说法正确的是
A.22.4LCO和CO2的混合气体中所含的碳原子数一定是NA
B.含1molHCl的盐酸溶液与足量Fe反应,Fe所失去的电子总数为2NA
C.常温常压下,32gO2和32gO3所含氧原子数都是2NA
D.标准状况下,11.2LH2O含有0.5NA分子
查看答案和解析>>
科目:高中化学 来源:2014~2015学年重庆市9月月考高一化学试卷(解析版) 题型:填空题
(14分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.①CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) △H1= —574 kJ·mol- 1 .
②CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g) △H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为 ;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
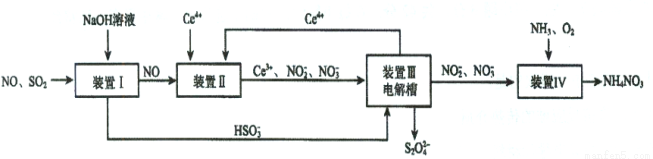
(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方
式 ;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
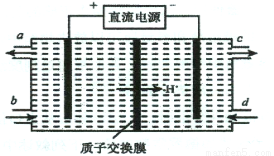
①生成的Ce4+ 从电解槽的 (填字母序号)口流出;
②生成S2O42 - 的电极反应式为 ;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com