
| A. | ①②③ | B. | ②③④ | C. | ①③⑤ | D. | ③④⑤ |
 53天天练系列答案
53天天练系列答案科目:高中化学 来源: 题型:解答题
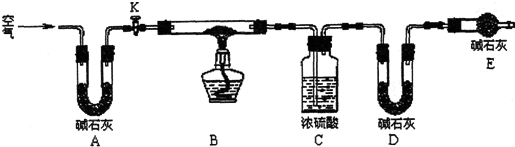
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P是氧化剂 | B. | 氧化性H2O2>Na2H2P2O6 | ||
| C. | 1mol H2O2反应,转移电子1mol | D. | Na2H2P2O6中磷元素的化合价为+3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O | |
| B. | 铜片与浓HNO3:Cu+2NO3-+4H+═Cu2++NO2↑+2H2O | |
| C. | 氯化铵浓溶液跟浓NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可 | |
| B. | 可用蘸有浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 碘是人体必需的微量元素,所以要多吃富含高碘酸的食物 | |
| D. | 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
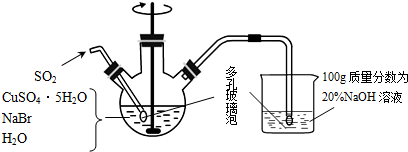
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式 | |
| B. | 按照规定对生活废弃物进行分类放置 | |
| C. | 经常使用一次性筷子、纸杯、塑料袋等 | |
| D. | 改进汽车尾气净化技术,减少大气污染物的排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com