
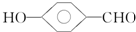
 的沸点比
的沸点比 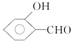 高,原因是
高,原因是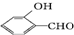 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.分析 (1)R原子的3p轨道上只有一个未成对电子,则R原子3p轨道上可能含有1个电子或5个电子,据此判断R元素;Y原子的核电荷数为33,则Y是As元素,其4s、4p电子为其外围电子,根据能量最低原理书写其外围电子排布式,主族元素的电子层数与其周期数相等、最外层电子数与其族序数相等,根据最后排入的电子判断该元素所属区域;
(2)化学键的键能大于氢键的键能,氢键的键能大于分子间作用力;
(3)根据等电子体的定义,只要原子数目和电子总数(或价电子总数)相同就是等电子体,CO分子含两个原子,且组成该物质的元素一个是6号一个是8号,找它的等电子体时,如果是分子,就把两种元素的原子序数一个增大1一个减小1,如果是离子,其中一种元素不变,另一种原子序数增大(或减小),带正电荷(或负电荷);(4)氢键对物质的物理性质产生影响,分子间氢键使物质的沸点升高,分子内氢键使物质的沸点降低;
(5)先确定VSEPR模型,然后在确定中心原子的杂化轨道类型,一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力;
解答 解:(1)R原子的3p轨道上只有一个未成对电子,则价层电子排布式为3s23p1或3s23p5,则R为Al元素或Cl元素,Y原子的核电荷数为33,则Y是As元素,其4s、4p电子为其外围电子,根据能量最低原理知其外围电子排布式4s24p3,主族元素的电子层数与其周期数相等、最外层电子数与其族序数相等,所以As元素位于第四周期第VA族,该元素最后排入的电子是p电子,所以As位于p区,故答案为:Al,Cl; 4S24P3,第四周期ⅤA,P区;
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为O-H键、氢键、分子间的范德华力,
故答案为:O-H键、氢键、范德华力;
(3)根据等电子体的定义,CO的等电子体必须是双原子分子或离子,且电子总数相等.对于原子,原子序数=原子核外电子总数,所以,如果是分子,只要原子序数之和相等即可.
CO中C是6号元素,O是8号元素,原子序数之和为14,N是7号元素,且可形成双原子分子,所以分子是N2.
如果是阳离子离子,原子序数之和减去所带电荷数值,如果是阴离子,原子序数之和加上所带电荷数值,等于CO的原子序数之和即可所以是CN-..
故答案为:N2、CN-;
(4)含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键,
故答案为: 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;
(5)H3O+价层电子对模型为四面体,氧原子采取sp3杂化,H3O+的空间构型是三角锥形,H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大,故答案为:sp3,三角锥形;H2O中O原子有2对孤电子对,H3O+只有1对孤电子对,排斥力较小.
点评 本题把物质结构和性质与有机化合物的性质融合成一体,考查学生对元素推理、原子轨道杂化类型、分子空间结构、氢键等知识的掌握和应用能力.本题基础性较强,难度较大.


科目:高中化学 来源: 题型:填空题
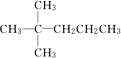 ,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.
,该烷烃分子的名称2,2-二甲基戊烷C7H16另一种同分异构体分子是由烯烃和氢气加成得到,而且该烯烃分子中的碳碳双键只有一种位置,试写出这种烯烃分子的名称3,3-二甲基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化 | |
| C. | 热化学方程式中,各物质前的化学计量数不表示分子个数 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
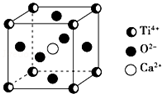 CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )
CaTiO3的晶体结构模型如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角),下列关于晶体的说法正确的是( )| A. | CaTiO3的摩尔质量为236 | |
| B. | CaTiO3晶体中每个Ti4+与12个Ca2+紧相邻 | |
| C. | CaTiO3晶体中每个Ti4+与12个O2-紧相邻 | |
| D. | CaTiO3晶体中每个Ti4+与12个Ti4+紧相邻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
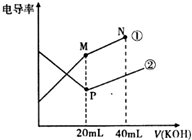
| A. | 曲线②代表0.1mol/L KOH溶液滴定CH3COOH溶液的滴定曲线 | |
| B. | 在相同温度下,P点水电离程度大于M点 | |
| C. | 在M点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L | |
| D. | 在N点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物中不可能含有离子键 | |
| B. | 阴阳离子之间通过静电作用力形成的化学键,叫离子键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 离子化合物中不一定含有金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com