
分析 常温下PH=2的某酸HnA(A为酸根)与PH=12的某碱B(OH)m等体积混合,混合液的PH变为5,说明HnA为弱酸,且酸过量,根据化合物中化合价的代数和为0确定其化学式,根据酸碱的相对强弱确定水解的离子.
解答 解:(1)HnA中A的化合价是-n价,B(OH)m中B的化合价是+m价,根据化合物中化合价的代数和为0知,二者的离子个数之比为n:m,则其化学式为:BnAm,
故答案为:BnAm;
(2)根据题意知,HnA为弱酸,则An-离子一定能水解,其水解方程式为:An-+H2O?HA(n-1)-+OH-;故答案为:An-+H2O?HA(n-1)-+OH-;
(3)混合液的PH变为5,说明HnA为弱酸,且酸过量,弱酸过量电离出H+,呈酸性,故答案为:弱酸过量电离出H+;
(4))HnA是弱酸,在水溶液中部分电离生成酸根离子和氢离子,电离方程式为HnA?(n-1)H++HA(n-1)-,故答案为:HnA?(n-1)H++HA(n-1)-.
点评 本题考查弱电解质的电离、离子浓度大小比较等知识点,侧重考查基本理论,明确混合溶液中的溶质及其性质结合溶液酸碱性判断离子浓度大小,难点是(3)题.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
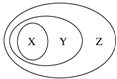 如表所列物质或概念间的从属关系符合如图所示关系的是( )
如表所列物质或概念间的从属关系符合如图所示关系的是( )| 选项 | X | Y | Z |
| A | 光导纤维 | 酸性氧化物 | 传统无机非金属材料 |
| B | 纯碱 | 碱 | 化合物 |
| C | 氧化物 | 化合物 | 纯净物 |
| D | H2SO4 | 含氧酸 | 强酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应A(g)+B(g)═2C(s)可以自发进行,则其必为放热反应 | |
| B. | 从C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol,可知:金刚石比石墨更稳定 | |
| C. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| D. | 若2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ•mol-1,则H2燃烧热为241.8 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入以上药品的顺序是a→e→b→c→d | |
| B. | ③→④反应的化学方程式为3I2+6NaOH═5NaI+NaIO3+3H2O | |
| C. | 溶液由棕黄色变为蓝色的原因是淀粉溶液遇碘变蓝色 | |
| D. | ④→⑤反应的粒子方程式为2I-+Cl2═I2+2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
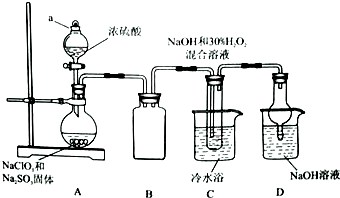 实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.
实验室欲制备高效漂白剂亚氯酸钠(NaCLO2),并对其样品进行分析.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | M与T形成的化合物具有两性 | ||
| C. | 气态氢化物的稳定性为H2T>H2R | D. | L和M金属性强弱比较:L>M |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com