
| A. | NaHCO3 | B. | NaHSO4 | C. | NH4Cl | D. | AlCl3 |
 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:实验题
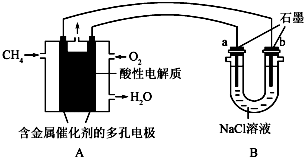
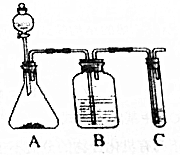 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.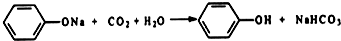 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
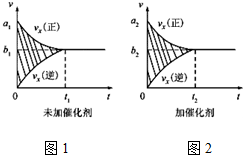
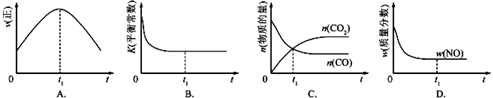
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子数相同的粒子不一定属于同种元素 | |
| B. | 两个原子如果核外电子排布相同,一定属于同种元素 | |
| C. | 质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 | |
| D. | 所含质子数和电子数相等的粒子一定是原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性 | B. | 还原性 | C. | 酸性 | D. | 碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①⑤ | B. | ②③⑤① | C. | ⑥③④① | D. | ⑥③①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 试剂 | 发生反应的离子方程式 |
| A | K+、AlO2-、NO3- | 过量CO2 | CO2+2H2O+AlO2-=Al(OH)3↓+HCO3- |
| B | Fe3+、I-、ClO- | 少量NaOH溶液 | Fe3++3OH-=Fe(OH) 3↓ |
| C | Ca2+、Na+、OH- | 少量NaHCO3溶液 | HCO3-+OH-=CO32-+H2O |
| D | NH4+、HCO3-、Cl- | 少量NaOH溶液 | NH4++OH-=NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com