
分析 (1)NaHCO3是盐能完全电离,溶液中HCO3-电离,HCO3-水解,但水解程度大于HCO3-电离程度,溶液呈碱性,据此即可解答;、
(2)①NH4NO3、②NaCl、③Na2CO3、④H2SO4、⑤NaOH、⑥CH3COONa,④为强酸⑤为强碱,②为强酸强碱盐,①为强酸弱碱盐,③⑥为弱酸强碱盐,醋酸的酸性比碳酸强;
(3)从盐类的水解角度分析,AlCl3的为强酸弱碱盐,水解呈酸性;为了抑制AlCl3的水解,可加入少量的硫酸.
解答 解:(1)NaHCO3是强碱弱酸盐,能完全电离NaHCO3═Na++HCO3-,所以溶液中存在Na+、HCO3-;溶液中HCO3-电离HCO3-?H++CO32-,所以溶液中存在H+、CO32-;溶液中HCO3-水解HCO3-+H2O?H2CO3+OH-,所以溶液中存在H2CO3、OH-,;但溶液中HCO3-水解程度大于HCO3-电离程度,溶液呈碱性;NaHCO3溶液必存在水;所以NaHCO3溶液中共存在7种微粒,它们是Na+、HCO3-、H+、CO32-、H2O、OH-、H2CO3,故答案为:OH-;H2CO3;
(2)①NH4NO3、②NaCl、③Na2CO3、④H2SO4、⑤NaOH、⑥CH3COONa,④为强酸⑤为强碱,②为强酸强碱盐,①为强酸弱碱盐,水解显酸性,但酸性比④弱,③⑥为弱酸强碱盐,水解显碱性,但碱性比⑤弱,醋酸的酸性比碳酸强,碳酸根离子水解程度大于醋酸根离子,溶液碱性强,所以其pH从大到小排列顺序为:⑤>③>⑥>②>①>④,故答案为:⑤>③>⑥>②>①>④;
(3)AlCl3为强电解质,在溶液中完全电离,生成Al3+离子和Cl-离子,电离方程式为AlCl3═Al3++3Cl-,Al3+水解离子方程式为:Al3++3H2O?Al(OH)3+3H+,AlCl3溶液呈酸性;故答案为:酸;Al3++3H2O?Al (OH)3+3H+.
点评 本题考查盐类水解的原理和应用,注意盐类水解的实质和把握弱电解质的电离,从影响平衡移动的角度分析离子浓度的大小比较是解答的关键,题目难度中等.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 氨水和液氨不同,氨水是混合物,液氨是纯净物 | |
| B. | 氨水中物质的量浓度最大的粒子是NH3•H2O(除水) | |
| C. | 氨水显弱碱性,故通常保存在金属容器中 | |
| D. | 在1 mol•L-1氨水中,NH3•H2O、NH${\;}_{4}^{+}$、NH3的物质的量浓度之和为1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CO2不是大气污染物,所以可以大量排放到空气中 | |
| B. | 以无磷洗涤剂代替含磷洗涤剂 | |
| C. | 实验后的有毒有害物质应分类收集,统一处理 | |
| D. | 在通风橱中制取氯气时不用NaOH溶液吸收尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )
2015年央视3.15晚会曝光了山东省东营市、滨州市许多不法厂商,把一部分90号的汽油配上大量的石脑油、芳烃、甲缩醛等调和成“93号汽油”.查资料知,甲缩醛是一种无色易挥发可燃液体,主要用于生产杀虫剂、皮革和汽车上光剂等,是现行的车用汽油国家标准中不得添加的有害物质,它易造成汽车线路漏油,对动物有麻醉作用,也有一定毒性.下列对其说法中正确的是( )| A. | 甲缩醛和乙醛互为同系物 | |
| B. | 用甲醇和甲醛生产甲缩醛的反应为加成反应 | |
| C. | 等物质的量的甲缩醛和丙炔完全燃烧的耗氧量相同 | |
| D. | 用甲缩醛生产杀虫剂、皮革和汽车上光剂等,均是利用了它的毒性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③④ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 的分子式为C12H16O.
的分子式为C12H16O. 分子中,处于同一平面上的原子数最多可能有16个.
分子中,处于同一平面上的原子数最多可能有16个. 系统命名为4,4-二甲基-2-戊醇.
系统命名为4,4-二甲基-2-戊醇.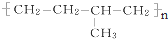 的单体为CH2=CH2、CH3-CH=CH2.
的单体为CH2=CH2、CH3-CH=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
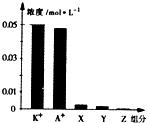 常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
常温下,0.1mol•L-1一元酸HA与等浓度KOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )| A. | 该混合溶液pH=7.0 | B. | 原HA溶液中:c(HA)>c(H+)>c(A-) | ||
| C. | 图中X表示HA,Y表示OH-,Z表示H+ | D. | 混合溶液中:c(X)+x(A-)=c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
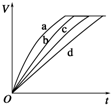 等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体
等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t产生氢气体| 组别 | c(HCl)/(mol•L-1) | 温度/(℃) | 状态 |
| 1 | 2.0 | 30 | 块状 |
| 2 | 2.5 | 30 | 块状 |
| 3 | 2.0 | 20 | 块状 |
| 4 | 2.5 | 30 | 粉末状 |
| A. | 4、3、2、1 | B. | 4、2、1、3 | C. | 3、4、2、1 | D. | 4、1、2、3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com