
| A、某盐的水溶液呈酸性,该盐一定是强酸弱碱盐 |
| B、盐类水解的过程破坏了水的电离平衡 |
| C、室温时向AgCl饱和溶液中加入AgNO3固体,c(Cl-)不变 |
| D、室温时pH=3的溶液与pH=11的溶液等体积混合所得溶液一定呈中性 |


科目:高中化学 来源: 题型:
 已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )
已知:还原性HSO3?>I?,氧化性IO3?>I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列不正确的是( )| A、0--b:3HSO3-+IO3-=3SO42-+I-+3H+ |
| B、a点时消耗NaHSO3的物质的量为1.2 mol |
| C、b~c间I2是还原产物 |
| D、当溶液中I?与I2的物质的量之比为5:2时,加入的KIO3为1.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.
X、Y、Z、W、R.均为前四周期元素且原子序数依次增大,X的基态原子核外有7种不同运动状态的电子,Y原子最外层有2对成对电子,Z的原子序数为Y的原子序数的2倍,W3+的基态离子3d轨道为半充满状态,R的氢氧化物悬浊液可用于检验葡萄糖的存在.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应:2O22-+2H2O═O2↑+4OH- |
| B、次氯酸钠与Fe(OH)3在碱性溶液中反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
| C、向明矾[KAl(SO4)2?12H2O]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好完全沉淀:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| D、向碳酸氢镁溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2Ca2++4OH-═Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B、C一定是非金属元素 |
| B、A、B、C一定是主族元素 |
| C、A可能是周期表中原子半径最小的元素 |
| D、A可能是周期表中非金属性最强的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 内容 | 评价 |
| A | 一定条件下0.5mol N2和1.5mol H2反应,平衡时放热a kJ,则N2(g)+3H2(g)?2NH3(g)△H=2a kJ?mol-1 | 正确 |
| B | 氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | 错误,氨水不应写成离 子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液: Ba2++SO42-═BaSO4↓ |
正确 |
| D | 等物质的量的Cl2与FeBr2在溶液中反应: 2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
错误,Fe2+与Br-的化学计量数之比应为l:2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将过量NaOH溶液滴入Ca(HCO3)2溶液中:Ca2++HCO3-+OH-═CaCO3↓+H2O |
| B、三氯化铁溶液中通入硫化氢气体:2Fe3++3H2S═Fe2S3↓+6H+ |
| C、用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-═Ag++NO2↑+H2O |
| D、4mol?L-1的NaAlO2溶液和7mol?L-1的HCl等体积互相均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2与H2O反应:Na2O2+H2O=2Na++2OH-+O2↑ |
| B、硫酸铝与过量氨水反应:Al3++4NH3?H2O=AlO2-+4NH4++2H2O |
| C、用FeCl3溶液腐蚀铜线路板:Cu+Fe3+=Cu2++Fe2+ |
| D、NO2溶于水:3NO2+H2O=2H++2NO3-+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
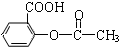 ).为测定某解热镇痛药阿斯
).为测定某解热镇痛药阿斯 冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.
冷却后用0.10mol/L HCl溶液返滴过量的NaOH,消耗该HCl溶液25.00mL.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com