
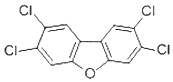
 香港食环署食物安全中心日前宣布,两个大闸蟹养殖场样本,被验出二噁英样多氯联苯含量超标.2,4,7,8-四氯二苯并呋喃是其中的一种,结构简式如图,下列有关该物质的说法正确的是( )
香港食环署食物安全中心日前宣布,两个大闸蟹养殖场样本,被验出二噁英样多氯联苯含量超标.2,4,7,8-四氯二苯并呋喃是其中的一种,结构简式如图,下列有关该物质的说法正确的是( )| A. | 能发生氧化反应 | B. | 一溴取代物只有一种 | ||
| C. | 属于氯代芳香烃 | D. | 易溶于水 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含1molFeCl3溶液水解生成1molFe(OH)3胶体后生成NA个胶体粒子 | |
| B. | 分子数为NA的N2,CO混合气体体积为22.4L,质量为28g | |
| C. | 0.5molFeBr2与足量氯气反应转移的电子数为NA | |
| D. | 足量Zn与一定量的浓硫酸反应,产生22.4L标准状况气体时,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学家可以在微观层面上操纵分子和原子,组装分子材料 | |
| B. | 化学是一门具有创造性的科学,化学的特征就是认识分子和制造分子 | |
| C. | 化学是在原子、分子的水平上研究物质的一门自然科学 | |
| D. | 化学注重理论分析、推理,而不需要做化学实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用滴定管前要检查是否漏液 | |
| B. | 用简易量热计测定反应热时,用环形玻璃搅拌棒进行搅拌使酸和碱充分反应,以达到良好的实验效果 | |
| C. | 用精密pH试纸测得某浓度氯水的pH为3.5 | |
| D. | 燃料电池实验中,用KNO3溶液或Na2SO4溶液代替蒸馏水,效果要好得多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥⑦ | B. | ①②④③⑥ | C. | ①⑥⑦ | D. | ①⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:3 | C. | 3:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源:2017届山东省高三上第一次教学诊断化学卷(解析版) 题型:填空题
I. 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为 。
(2)写出该反应的化学方程式_________________,若反应中生成0.2 mol HNO3,转移的电子数目为____________个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现,你判断该气体泄漏时的现象是 。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有__________(填化学式) 。
II.(1)已知Fe(OH)3能与次氯酸盐发生如下反应(未配平):Fe(OH)3+ClO-+OH-→FeO4n-+Cl-+H2O
①已知有10.7 g Fe(OH)3参加反应,共转移了0.3NA个电子,则n = ,FeO4n- 中铁元素的化合价为 。
② 根据所学的知识,推测FeO4n- 能和下列 (填序号)物质反应。
A.KMnO4 B.SO2 C.H2S D.O2
(2)一定条件下,含硝酸的废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH,转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com