
| A. | 1.6 g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA | |
| B. | 2.24 L CO2中含有的原子数为0.3NA | |
| C. | 相同质量的N2O4与NO2中所含原子数目不相同 | |
| D. | 100 g 17%的氨水,溶液中含有的NH3分子数为NA |
分析 A、氧气和臭氧均由氧原子构成;
B、二氧化碳所处的状态不明确;
C、N2O4与NO2的最简式均为NO2;
D、氨气溶于水后和水部分反应,生成NH3•H2O.
解答 解:A、氧气和臭氧均由氧原子构成,故1.6g混合物中含有的氧原子的物质的量为0.1mol,即0.1NA个,故A正确;
B、二氧化碳所处的状态不明确,故其物质的量和含有的原子个数无法计算,故B错误;
C、N2O4与NO2的最简式均为NO2,故相同质量的两者中含有的NO2的物质的量相同,则原子个数相同,故C错误;
D、氨气溶于水后和水部分反应,生成NH3•H2O,故此氨水中含有的氨气分子个数小于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


科目:高中化学 来源: 题型:实验题
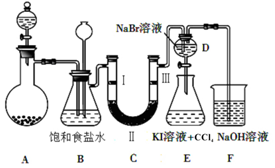
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
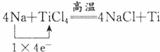 ,氧化剂:TiCl4,还原剂:Na.
,氧化剂:TiCl4,还原剂:Na.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4在熔融的状态下能够导电是因为:NaHSO4═Na++HSO4- | |
| B. | pH=1的无色溶液中能大量共存的离子有:CO32-、Na+、Cl-、Ba2+ | |
| C. | 能用Fe3++3OH-=Fe(OH)3↓表示的化学方程式可以是:2Fe(NO3)3+3Mg(OH)2═2Fe(OH)3↓+3Mg(NO3)2 | |
| D. | 铜片和稀HNO3反应离子方程式为:Cu+4H++NO3-═Cu2++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂是SiO2 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 由反应可得C的还原性比Si强 | |
| D. | 若生成1 mol SiC,则转移电子2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,11.2LN2所含有的原子数目为NA | |
| B. | 活泼金属从盐酸中置换出1molH2,电子转移的数目为NA | |
| C. | 500mL0.5 mol/L的硫酸铝溶液中,硫酸根离子的浓度为1.5 mol/L | |
| D. | 1.7克氨气所含有的电子数目为10 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液 | 杂质 | 应加试剂 | 离子方程式 |
| BaCl2 | HCl | ||
| Na2SO4 | Na2CO3 | ||
| FeCl2 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com