
| A. | 陶瓷、玻璃、水泥容器都能贮存氢氟酸 | |
| B. | 硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞的试剂瓶中 | |
| C. | 用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2 | |
| D. | 由Na2CO3+SiO2 $\frac{\underline{\;高温\;}}{\;}$CO2+Na2SiO3可知硅酸的酸性大于碳酸 |
分析 A.陶瓷、玻璃、水泥的主要成分都是硅酸盐;
B.硅酸钠具有粘性,是弱酸强碱盐,呈碱性,会腐蚀磨口玻璃,造成玻璃塞和瓶体粘在一起,不便于打开;
C.二氧化硅难溶于水,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,碳酸的酸性强于硅酸,可利用强酸制弱酸的规律制取硅酸;
D.该反应之所以能发生是因为生成了气体二氧化碳.
解答 解:A.陶瓷、玻璃、水泥的主要成分都是硅酸盐,其中含有的二氧化硅都能和氢氟酸反应,故A错误;
B.硅酸钠是一种无机粘合剂,能将玻璃塞和瓶体粘在一起,硅酸钠属于弱酸强碱盐,水解呈碱性,磨口玻璃塞中玻璃成分二氧化硅能和碱反应,生成具有粘性的硅酸钠,造成玻璃塞和瓶体粘在一起,不便于打开,所以硅酸钠不可以保存在磨口玻璃塞试剂瓶中,故B错误;
C.二氧化硅难溶于水,所以无法用二氧化硅和水直接反应制得,用SiO2制取硅酸,先使二氧化硅与氢氧化钠溶液反应,SiO2+2NaOH=Na2SiO3+H2O,因碳酸酸性强于硅酸且硅酸溶解度较小易沉淀,所以通入CO2,发生Na2SiO3+CO2 +H2O=H2SiO3↓+Na2CO3,制得硅酸,故C正确;
D.酸性强弱的比较只有在没有外界条件干扰化学反应时才能比较,Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$CO2+Na2SiO3中反应条件为高温干扰化学反应,所以不能说明硅酸酸性比碳酸酸性强,一般在溶液中强酸可制得弱酸,即硅酸钠溶液中通入CO2,制得硅酸说明碳酸酸性强于硅酸,故D错误;
故选C.
点评 本题考查氧化还原反应、二氧化硅、硅酸钠、硅酸的制备等知识,明确物质的性质是解答的关键,注意二氧化硅难溶于水,注意从得氧失氧的角度来认识氧化和还原反应,注意酸性强弱的比较只有在没有外界条件干扰化学反应时才能比较,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 吸收208 kJ的热量 | B. | 放出208 kJ的热量 | ||
| C. | 吸收93 kJ的热量 | D. | 放出93 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol•L-1的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| B. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,则氢气的标准燃烧热为-483.6kJ/mol | |
| B. | △H的数值与化学反应方程式的化学计量系数无关 | |
| C. | 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则该反应的热化学方程式为:NaOH(aq)+$\frac{1}{2}$H2SO4(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.4 kJ•mol-1 | |
| D. | 己知C(s)+O2(g)═CO2(g)△H1;C(g)+O2(g)═CO2(g)△H2,则△H1<△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-480.4kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-240.2kJ/mol | ||
| C. | 2H2(g)+O2(g)═2H2O(g)△H=+480.4kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-480.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 右图的键线式表示烃的名称为:3-甲基-4-乙基-7-甲基辛烷 | |
| B. | 符合分子式为C3H8O的醇有三种不同的结构 | |
| C. | 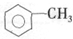 中,所有原子不可能都在同一平面上 中,所有原子不可能都在同一平面上 | |
| D. | 治疗疟疾的青蒿素(如图)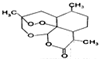 ,分子式是C15H20O5 ,分子式是C15H20O5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com