
| A. | 7.8 g Na2O2中所含阴离子的数目是0.2NA | |
| B. | 标准状况下,22.4 L SO3含分子数为NA | |
| C. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| D. | 用足量NaOH溶液完全吸收1 mol Cl2时,转移电子的数目是2NA |
分析 A、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;
B、标况下三氧化硫为固体;
C、求出氧气18O2的物质的量,然后根据18O2中含20个中子来分析;
D、氯气和碱的反应为歧化反应.
解答 解:A、7.8g过氧化钠的物质的量为0.1mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.1mol过氧化钠中含0.1NA个阴离子,故A错误;
B、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和含有的分子个数,故B错误;
C、标况下2.24L氧气18O2的物质的量为0.1mol,而18O2中含20个中子,故0.1mol氧气中含2NA个中子,故C正确;
D、氯气和碱的反应为歧化反应,1mol氯气转移NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 工业粉尘中含有Pb、Cd、Cr、V、As等金属元素,过量摄入均对人体有害 | |
| C. | 用工业明胶制作用药胶囊,会导致过量Cr元素摄入人体而提高致癌风险 | |
| D. | 分光光度计通过测定溶液颜色分析反应物(或生成物)浓度变化,从而确定化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应实质是旧键断裂新键形成,化学反应中的能量变化本质原因就是旧键断裂所吸收的能量和新键形成所释放的能量不同 | |
| B. | 极性键就是共用电子对发生偏移的共价键 | |
| C. | 氢键是一种比较弱的化学键 | |
| D. | 水结冰时体积膨胀、密度减小就是因为氢键的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol/L | B. | 0.4 mol/L | C. | 0.5 mol/L | D. | 0.6 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L Na2CO3溶液中的Na+数目为2NA | |
| B. | 电解Na2SO4饱和溶液,若生成2 NA个H2,一定生成NA个O2 | |
| C. | 常温常压下,46 g NO2的原子数为3NA | |
| D. | 1 mol NO,与H2O完全反应时转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
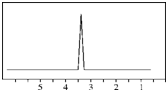 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)有2个且峰的面积比为3:2的是CD(多选)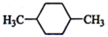 B、
B、 C、
C、 D、CH3CH2CH2CH3
D、CH3CH2CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期原子序数依次增大的元素.其中A、B、C是同一周期的非金属元素.D与C可以形成两种常见的离子晶体,D的阳离子与C的阴离子具有相同的电子层结构.AC2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物M,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于2:7 | B. | 等于2:7 | C. | 大于2:7 | D. | 无法肯定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com