
16 8 |
 ,故答案为:
,故答案为:16 8 |
 ;
;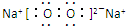 ,故答案为:直线型;
,故答案为:直线型;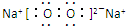 ;
;

科目:高中化学 来源: 题型:
A、Be原子的结构示意图 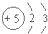 |
| B、乙醇的结构简式:C2H5OH |
| C、明矾的化学式KAlSO4?12H2O |
| D、乙烯的结构式:CH2=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AlCl3溶液中加入过量氨水 |
| B、Al2(SO4)3溶液中加入过量KOH溶液 |
| C、FeCl2溶液中加入过量氨水 |
| D、Ca(OH)2溶液中通入过量SO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
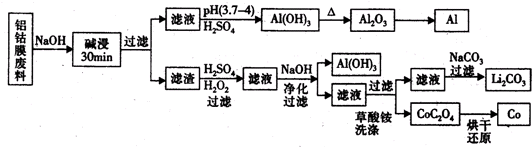
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
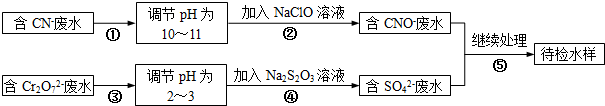
查看答案和解析>>
科目:高中化学 来源: 题型:
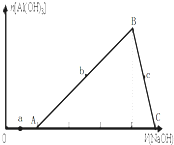 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )| A、在a点对应的溶液中,加入Mg2+、I-、NH4+、NO3-离子仍能大量共存 |
| B、原溶液中盐酸和AlCl3物质的量的浓度之比为1:3 |
| C、若b、c的纵坐标数值相同,则横坐标数值之比为1:3 |
| D、图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
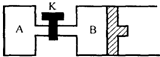 如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.
如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com