
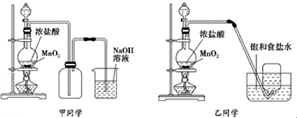
| 实验序号 | 实验操作 | 现象 | 结论 |
| ① | 加品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| ② | 加入NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
| 实验序号 | 甲 | 乙 |
| ① | ||
| ② |
| ||
| ||
| 实验序号 | 甲 | 乙 |
| ① | 合理 | 合理 |
| ② | 不合理 | 合理 |


科目:高中化学 来源: 题型:
| A、金属与盐溶液间的反应一定是置换反应 | ||||
| B、能与酸反应的氧化物一定是碱性氧化物 | ||||
C、
| ||||
| D、常见金属铁和铝在工业上是由热还原法制得的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
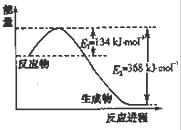
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
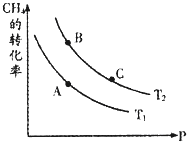 生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)?CO(g)+3H2(g),试回答下列问题.
生产甲醇的原料CO、H2可由下列反应制取:CH4(g)+H2O(g)?CO(g)+3H2(g),试回答下列问题.| 3 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
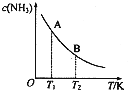 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题: | c(N2) | c(H2) | c(H2) |
| 0 | 0.6 | 1.8 | 0 |
| 3 | 0.52 | x | 0.16 |
| 6 | 0.36 | 1.08 | 0.48 |
| 9 | 0.36 | 1.08 | 0.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com