
| A. | 将Fe(NO3)2样品溶于稀硫酸,滴入KSCN溶液,溶液变红色,则样品已变质 | |
| B. | NaBr溶液中滴入少量氯水和CCl4,震荡,有机相呈橙色,则还原性:Br->Cl- | |
| C. | 某试液中滴入BaCl2溶液和稀硝酸有白色沉淀,则试液中一定含SO42-或SO32- | |
| D. | 溴乙烷与NaOH的乙醇溶液共热,逸出的蒸气直接通入酸性高锰酸钾溶液,溶液紫色褪去,则逸出的蒸气一定为纯净的乙烯 |
分析 A.酸性条件下,硝酸根离子能氧化亚铁离子生成铁离子;
B.同一氧化还原反应中,还原剂的还原性大于还原产物的还原性;
C.HSO3-也能被氧化生成SO42-;
D.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色.
解答 解:A.酸性条件下,硝酸根离子能氧化亚铁离子生成铁离子,所以要检验硝酸亚铁溶液是否变质,应该直接用KSCN溶液检验即可,不需要加入酸溶液,故A错误;
B.同一氧化还原反应中,还原剂的还原性大于还原产物的还原性,该实验中有机相呈橙色,说明溴离子被氧化生成溴,氯气被还原生成氯离子,该反应中溴离子是还原剂、氯原子是还原产物,则Br->Cl-,故B正确;
C.HSO3-也能被氧化生成SO42-,所以该实验现象不能确定一定含SO42-或SO32-,故C错误;
D.乙醇也能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,从而影响乙烯的检验,应该用溴水检验,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及离子检验、氧化还原反应、物质检验等知识点,明确实验原理、物质性质是解本题关键,侧重考查学生分析判断能力,离子或物质检验时要排除其它物质或离子的干扰,易错选项是D.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验②中增大Fe3+浓度使平衡Fe3++3SCN-?Fe(SCN)3正向移动 | |
| B. | 实验③中发生反应:Fe3++3OH-═Fe(OH)3↓ | |
| C. | 实验③和④中溶液颜色变浅的原因相同 | |
| D. | 实验②、③、④均可说明浓度改变对平衡移动的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
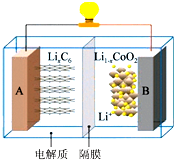 钴酸锂(LiCoO2)电池工作原理如图,A 极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )
钴酸锂(LiCoO2)电池工作原理如图,A 极材料是金属锂和石墨的复合材料(石墨作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2$?_{充电}^{放电}$C6+LiCoO2.下列说法不正确的是( )| A. | 充电时Li+由A极区域移向B极区域 | |
| B. | 充电时,A为阴极,发生还原反应C6+xLi++xe-=LixC6 | |
| C. | 放电时,B为正极,电极反应式为 Li1-xCoO2+xLi++xe-=LiCoO2 | |
| D. | 废旧钴酸锂(LiCoO2)电池进行“充电处理”使锂进入石墨中而有利于回收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
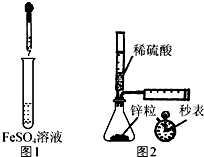
| A. | 制备Fe(OH)2:用图1所示装置,向试管中加入NaOH溶液,振荡 | |
| B. | 测定H2的生成速率:用图2所示装置,制取一定体积的H2,记录时间 | |
| C. | 除去苯中少量苯酚:向苯和苯酚的混合液中加入浓溴水,过滤 | |
| D. | 检验淀粉是否水解:取0.5 g淀粉于洁净的试管中,先加入5 mL稀硫酸,水浴加热,一段时间后再加入少量新制氢氧化铜悬浊液,水浴加热,观察实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
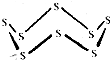 黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )
黑火药是我国古代的四大发明之一,KNO3、C及S8 (结构式如图所示)爆炸生成K2S、CO2和N2,下列说法正确的是( )| A. | 该反应属于置换反应 | |
| B. | 该反应中氧化剂只有KNO3 | |
| C. | 32g S8含有S-S的数目约为6.02×1023 | |
| D. | 1mol KNO3参与该反应,转移电子总数目约为5×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:
某校研究小组欲研究外界条件对H2O2分解反应速率的影响,设计的实验方案如下表,并测量收集V mL气体所需的时间:| 实验序号 | 5%H2O2溶液 | 水 | 溶液温度 | 1mol/L FeCl3溶液 | 所用时间 |
| ① | 10.0ml | 0.0ml | 20℃ | 2滴 | t1 |
| ② | 9.0ml | 1.0ml | 40℃ | 2滴 | t2 |
| ③ | 5.0ml | Vx ml | 20℃ | 2滴 | t3 |
| ④ | 9.0ml | 1.0ml | 40℃ | 0 | t4 |
| ⑤ | 9.0ml | 1.0ml | 20℃ | 2滴 | t5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
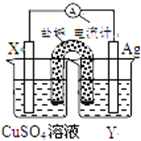 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com