
| A、2 | B、3 | C、4 | D、6 |
科目:高中化学 来源: 题型:
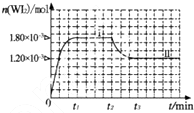 卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义.
卤素单质的性质活泼,卤素的化合物应用广泛,运用化学反应原理研究卤族元素的有关性质具有重要意义.| c(H+) |
| c(ClO-) |
| 弱酸化学式 | HClO | H2CO3 |
| 电离平衡常数 | K=3.0×10-8 | K1=4.4×10-7,K2=4.7×10-11 |
| c(WI2) |
| c(W)?c(I2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13C和14C属于同一种元素,它们互为同位素 |
| B、2H和3H是不同的核素,它们的质子数不相等 |
| C、14C和14N的质量数相等,它们的中子数相等 |
| D、6Li和7Li的电子数相等,中子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
| B、AgCl悬浊液中滴加KI,出现黄色沉淀:AgCl+I-?AgI+Cl- |
| C、在银氨溶液中滴加过量稀硝酸:[Ag(NH3)2]++2H+═Ag++2NH4+ |
D、水杨酸(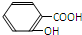 )与过量的Na2CO3溶液混合: )与过量的Na2CO3溶液混合: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、48gO2、O3组成的混合物,在任何温度、压强下,不管混合物中各组分的比例,所含的原子数均为3NA |
| B、在标准状况下,18g水蒸气所占有的体积约为22.4 L |
| C、用浓盐酸与二氧化锰反应制取氯气,若有0.4 mol HCl被氧化,则可制得氯气4.48 L |
| D、物质的量为1mol的任何物质在任何条件下含有的微观粒子数均为1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=12的溶液中:K+、Na+、Br-、AlO2- |
| B、无色溶液中:H+、K+、MnO4-、C2O42- |
| C、c(Fe3+)=0.1mol?L-1的溶液中:K+、H+、SCN-、I- |
| D、由水电离出的c(OH-)=1.0×10-13mol?L-1的溶液中:Na+、NH4+、SO42-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H2)?c(CO) |
| c(H2O) |
| T/K | 300 | 400 | 500 | … |
| K/(mol2?L-2) | 6×106 | 2×107 | K1 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
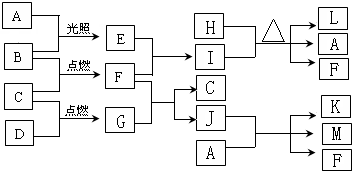
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com