
����Ŀ����1�����λ�����Ⱦ��������̬�����ѳ�Ϊȫ��Ĺ�ʶ��
�ٿ�����������ĸ���ָ�������ֿ��������������и���ָ�겻��Ҫ������___________��
A������������PM2.5�� B��NO2Ũ�� C��SO2Ũ�� D��CO2Ũ��
�����д�ʩ�����ڸ��ƻ�����������___________��
A�����ϵ�������Լ����ؽ�������Ⱦ
B�����ع��ͻ����ټӹ�Ϊʳ���ͣ��Լ���ˮ�帻Ӫ����
C�����ö�����̼��ԭ�Ϻϳɾ�̼������ɽ������ϴ������ϩ
��2����ȡ�ʵ��Ĵ�ʩ�ܼ��ٶԻ�������Ⱦ��
��������ָpH___________�Ľ�ˮ������ȼ�պ���ú������������ˮ���䵽���棬pH��ʱ��䳤��������С�����û�ѧ����ʽ������ԭ��___________��
��һ����̼Ҳ�dz����Ĵ�����Ⱦ������������������еIJ���ȫȼ�տɱ�ʾΪ2C8H18+23O2![]() 12CO2+4CO+18H2O
12CO2+4CO+18H2O
ij���������ȤС���ͬѧ���������ĵ���������CO�����仯����(�������ʾ����ʱ��0��24Сʱ���������ʾCO����)������Ϊ�ȽϷ���ʵ�ʵ���____________��

A B C D
����Ȼˮ�к��е�ϸС��������������___________����������д���ƣ����о�����������ҵ��ˮ�к��е�Cr3+���ӣ�������ʯ��������������pHΪ8��9ʱ���ɳ�������ȥ���÷�Ӧ�����ӷ���ʽ��_____________��
��3��ʳƷ��ҩƷ��ϵ�˵�����ͽ�����
���г������۵�ʳ��Ʒ�ֺܶࡣ����ʳ���У������ӵ�Ԫ�ز��������������Ԫ�ص���___________������ĸ����
A����п�� B���ӵ��� C���Ӹ���
����ά�ر���Ϊ������Ӫ��������ʳ���е���ά����Ȼ����Ϊ�����ṩ���������ܴٽ������䶯�������ų��к����ʡ��ӻ�ѧ�ɷֿ�����ά����һ��___________������ĸ����
A������ B�������� C��֬��
��ijͬѧ��ð���գ����ɷ�����������ҩƷ��������____________������ĸ����
A����Ƽ��� �� B����˾ƥ�� ��C������ҩ
��4����ѧ�����������ء�
���˹��ϳɵ������ж��֣����о���ϩ�dz�����������Ʒ���ṹ��ʽ��___________��
�ڸ����ĸ�ʴ��Ҫ����������ʴ���������ĵ缫��ӦΪ___________��Ϊ��ֹ�ִ��Ĵ����ں�ˮ�б���ʴ��һ���ڴ�������_____________������п��������ͭ��������
���𰸡� D C ��5.6 2H2SO3+O2 == 2H2SO4 C ���� Cr3++3OH�� == Cr(OH)3�� C A �������10��B ![]() O2+2H2O+4e��= 4OH�� п��
O2+2H2O+4e��= 4OH�� �
��������(1)�ٶ�����̼���������ڿ�����Ⱦ�������������NO2��SO2��Ϊ��Ⱦ���Ҫ��⣬��ѡD��
��A�����ϵ�������������������ˮ����Ⱦ����A����B�����ع��ͻ����ټӹ�Ϊʳ���ͣ�ֱ��Ӱ������Ľ�������B����C�����ö�����̼��ԭ�Ϻϳɾ�̼������ɽ������ϴ������ϩ�����ٰ�ɫ��Ⱦ����C��ȷ����ѡC��
(2)��������ָpH��5.6�Ľ�ˮ������ȼ�պ���ú������������ˮ���䵽���棬�����ᱻ�����е���������Ϊ���ᣬ���pH��ʱ��䳤��������С����ѧ����ʽΪ2H2SO3+O2 == 2H2SO4���ʴ�Ϊ����5.6��2H2SO3+O2 == 2H2SO4��
�� CO��Ҫ�dz���ȼ�Ͳ����ȼ�ն����ɵģ������Ĵ���ʹ�ýϼ������������°�ʱ������8�㡢11�����ң�����2�㡢6�㣬ҹ����٣�����ȤС���ͬѧ��������CO�����仯�����У�C�ȽϷ���ʵ�ʣ���ѡC��
��������������ˮ�����ɽ��壬���������Կɾ���ˮ����ҵ��ˮ�к��е�Cr3+���ӣ�������ʯ��������������pHΪ8��9ʱ���ɳ�������ȥ����Ӧ�����ӷ���ʽΪCr3++3OH-=Cr(OH)3�����ʴ�Ϊ��������Cr3++3OH-=Cr(OH)3����
(3)��ʳ����һ�����Ӻ���Ԫ�ص����ʡ���пԪ�ص����ʣ���ʳ���в���Ҫ�Ӻ���Ԫ�ص����ʣ��ʴ�Ϊ��C��
�ڵ��ۡ���ά�ض����ڶ��ǣ��ʴ�Ϊ��A��
�۸�ð����ʱӦ�������ס�ֹ�ȵ�ҩ��簢˾ƥ�֣��ʴ�Ϊ��B��
(4)�پ۱�ϩ�ĵ���Ϊ��ϩ�������ϩ�Ľṹ��ʽ��![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�ڸ����ĸ�ʴ��Ҫ����������ʴ�������������õ��ӣ��缫��ӦΪO2+4e-+2H2O=4OH-�����ڴ����ϼӱ������õĽ���������������������Zn��Fe��Cu����Ӧѡп�飬�ʴ�Ϊ��O2+4e-+2H2O=4OH-��п����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����ȼ�ϵ��������ϩΪԭ���Ʊ���ȩ����õ��ܣ�����ԭ����ͼ��ʾ�������й�˵����ȷ����

A. a �缫Ϊ����
B. �����ƶ�����a �缫��������Һ��b�缫
C. a ���ĵ缫��ӦʽΪCH2=CH2+2OH--2e-=CH3CHO+H2O
D. �ŵ�ʱ������2mol����ת�ƣ�����������Ҫ����28g��ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���������������أ�����˵����ȷ����( )
A. ���ڡ��л����������ά�����л��߷��ӻ�����
B. ���к��зḻ�ĵ����ʣ�������к��ʱ�Ϊ�˰�����
C. �ϳ���ά����ľ��Ϊԭ�ϣ�����ѧ�ӹ���������
D. ������Ⱦ�ϡ�ҽҩ��ũҩ�ȵķ������ʿ���Դ��ú�ĸ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NH3��N2H4�ڹ�ҵ�������������ж��й㷺Ӧ�á��ش��������⣺
��1����N2H4 (g) ![]() N2(g)+2H2(g) ��H1
N2(g)+2H2(g) ��H1
��N2(g)+3H2(g) ![]() 2NH3(g) ��H2
2NH3(g) ��H2
��7N2H4(g) ![]() 8NH3(g)+3N2(g)+2H2(g) ��H3
8NH3(g)+3N2(g)+2H2(g) ��H3
��H3=___________���ú���H1�͡�H2�Ĵ���ʽ��ʾ����
��2�������ܵĴ������£�N2H4�ɷֽ������������壬����һ����ʹʪ��ĺ�ɫʯ����ֽ����������Ӧ�ڲ�ͬ�¶��´ﵽƽ��ʱ����������и���ֵ����������ͼ��ʾ��

�÷�Ӧ�ġ�H________���>����<����0��N2H4�����ֽⷴӦ�Ļ�ѧ����ʽΪ___________��
��3��T��ʱ����һ���Ϊ5L �ĺ����ܱ������г��������ʵ���Ϊ2 mol��CO2��NH3����һ�������·�����Ӧ��2NH3(g)+CO2(g��====CO(NH2)2(s)+H2O(g)����������а�������������淴Ӧʱ��ı仯��ͼ��ʾ��

�� 0��60s�ڣ���Ӧ����v(CO2)=________mol/(L��s)
�� T��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��ѧ��ȤС���ڼ��н��л�ѧʵ�飬����ͼ1���Ӻ���·���ֵ��ݲ���������ͼ2���Ӻ���·���ֵ��������ɴ˵ó��Ľ�����ȷ���ǣ� �� 
A.NaCl�Ƿǵ����
B.NaCl��Һ�ǵ����
C.NaCl��Һ��ˮ���������������
D.NaCl��ˮ��Һ�е�����˿��������ƶ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������й��Ļ��Ļ걦�����г����漰�Ľ����ڳ����²�����Ũ�������
A. ͭ�ǵ�©B. ����Ϊ��C. ��������D. ����ͭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ṹ�������ʣ����ʷ�ӳ�ṹ���ǻ�ѧѧ����Ҫ��ѧ��˼�룬���л���ѧ��������Ϊ���ԡ��ݴ˻ش��������⣺
��1���л���ѧ�аѽṹ���ơ��������������ɸ���CH2��ԭ���ŵ��л������ﻥ��Ϊͬ ϵ�ͬϵ��Ļ�ѧ����һ��_________(���ͬ���������ơ���ͬ��)�������л�����һ������ͬϵ�����____________(�����)��
��C3H4��C5H8 �������Ӳ֬�ᣨC17H35COOH��
��![]() ��
��![]() �ܵ��ۺ���ά�� �ݱ�ϩ�;���ϩ
�ܵ��ۺ���ά�� �ݱ�ϩ�;���ϩ
��HOOCCH=CHCOOH��HOOCCH=C(CH3)COOH
��2�����л����У���ͬһ���������Ӳ�ͬ����ʱ������ֳ���������Ҳ������ͬ�����л���A��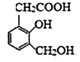 ���ķ�����������������-OH������������ֱ�����ӵĻ��Ų�ͬ�����»����Բ�ͬ������ת����ϵ��ѡ�õ��Լ�Ϊ��________����________����_______��
���ķ�����������������-OH������������ֱ�����ӵĻ��Ų�ͬ�����»����Բ�ͬ������ת����ϵ��ѡ�õ��Լ�Ϊ��________����________����_______��

ȩ��ͪ�ķ����ж������ʻ���![]() ������ֻ��ȩ�ܱ�����������������д����������������Һ��Ӧ�Ļ�ѧ����ʽ��_____________ ��
������ֻ��ȩ�ܱ�����������������д����������������Һ��Ӧ�Ļ�ѧ����ʽ��_____________ ��
��3��ij��A����Է�������Ϊ140,����̼����������Ϊ0.857��A������������̼ԭ�� ������ֱ��������A��һ������������ֻ����G��G��ʹʯ����Һ��졣
��֪��
�����G�Ľṹ��ʽΪ__________ ����A��һ�����������ɸ߷��ӻ�����Ļ�ѧ����ʽΪ_______________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ�����
��1����֪ʵ�����Ʊ���������ͨ�����ȸ������ʵ�֣��䷢���ķ�Ӧ���£�2KMnO4 ![]() K2MnO4+MnO2+O2�����б�������Ԫ���� �� ��ԭ������ ��
K2MnO4+MnO2+O2�����б�������Ԫ���� �� ��ԭ������ ��
��2���������Ͽ�֪��ͭ��ŨH2SO4���ȣ��������·�Ӧ��Cu+2H2SO4 ![]() CuSO4+SO2��+2H2O�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ �� ����H2SO4�ڷ�Ӧ�������ԣ�
CuSO4+SO2��+2H2O�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ �� ����H2SO4�ڷ�Ӧ�������ԣ�
��3����һ�������£�RO3n���ͷ����ɷ������·�Ӧ��RO3n��+F2+2OH��=RO4��+2F��+H2O�Ӷ���֪��RO3n����Ԫ��R�Ļ��ϼ��� ��
��4������˫���ű�ʾ���з�Ӧ����ʽ��ת�Ƶĵ�����Ŀ������
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2��+7H2O
����Ӧ�У�����������Ӧ��HClΪ1.2mol����ԭ��K2Cr2O7���ʵ���Ϊ mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��Ũ�ȵ�CuSO4��Һ��NaOH��Һ��Ӧ�����ɼ�ʽ��Cux(OH)y(SO4)z��Ϊ�˲ⶨ�ü�ʳ�ε�
��ɣ�����������ʵ�飺
�ٳ�ȡ��Ʒ2.270g����������ϡ�����ܽ����50.00mL��Һ������������BaCl2��Һ���õ� BaSO4 l.l65g��
����ȡ��Ʒ2.270g������������ϡ�������l00.00mL��Һ��ȡ25.00mL��Һ��������KI��Һ (��ѧ����ʽΪ2Cu2++4I-=2CuI��+I2����ַ�Ӧ���Ե���Ϊָʾ������0. 2500mol/LNa2S2O3��Һ�ζ����ɵ�I2�����ӷ���ʽΪ2S2O32-+I2=2I-+S4O52-��������Na2S2O3��Һ20.00mL��
��1��д��CuSO4��NaOH��Ӧ����Cux(OH)y(SO4)z�Ļ�ѧ����ʽ______________����x��y��z��ʾ��ѧ����������
��2���ζ��յ�ʱ��Һ���ɫ�仯��__________��
��3��ͨ������ȷ���ü�ʳ�εĻ�ѧʽ(д���������)___________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com