
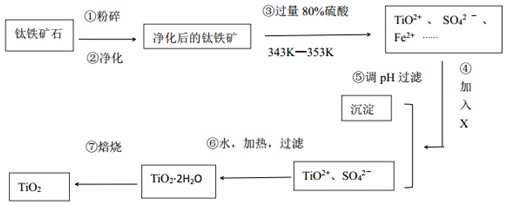
分析 钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH-=2AlO2-+H2O、
SiO2+2OH-=SiO32-+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K-353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4,加入X并调节溶液的pH得到沉淀和TiO2+、SO42-,说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42-加热、过滤得到TiO2.2H2O,焙烧得到TiO2;
(1)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水;
(2)④X应该具有强氧化性,且不能引进杂质;
(3)④⑤两步的目的是除去亚铁离子;
(4)⑥中TiO2+水解生成TiO2.2H2O;
(5)TiO2与Cl2、C反应得到TiCl4,同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁;
(6)阴极上得电子反应还原反应生成金属钛;
(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳.
解答 解:钛铁矿石粉碎、净化,净化时加入浓NaOH溶液,发生的反应为Al2O3+2OH-=2AlO2-+H2O、
SiO2+2OH-=SiO32-+H2O;
然后向钛铁矿石中加入过量80%硫酸并加热至343K-353K,发生反应2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O,FeO和硫酸反应生成FeSO4,加入X并调节溶液的pH得到沉淀和TiO2+、SO42-,说明加入X后将亚铁离子氧化为铁离子然后调节溶液pH值将铁离子沉淀,
然后将TiO2+、SO42-加热、过滤得到TiO2.2H2O,焙烧得到TiO2;
(1)两性氧化物是氧化铝,和NaOH溶液反应生成盐和水,离子反应方程式为Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
(2)④X应该具有强氧化性,且不能引进杂质,具有氧化性的是双氧水和高锰酸钾溶液,但高锰酸钾溶液氧化亚铁离子时引进新的杂质,故选A;
(3)④⑤两步的目的是除去亚铁离子,防止制得的二氧化钛中含有杂质,故答案为:除去亚铁离子;
(4)⑥中TiO2+水解生成TiO2.2H2O,反应方程式为TiOSO4+3H2O=TiO2•2H2O↓+H2SO4,
故答案为:TiOSO4+3H2O=TiO2•2H2O↓+H2SO4;
(5)TiO2与Cl2、C反应得到TiCl4,同时生成二氧化碳或CO,再用镁还原得到Ti和氯化镁,则生成四氯化钛的反应方程式为TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO,
故答案为:TiO2+Cl2+C=TiCl4+CO2或TiO2+Cl2+2C=TiCl4+2CO;
(6)阴极上得电子反应还原反应生成金属钛,电极反应式为TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti),
故答案为:TiO2+4e-=Ti+2O2-(或Ti4++4e-=Ti);
(7)阳极上氧离子失电子生成氧气,氧气和C反应生成二氧化碳,所以需要定期补充碳,
故答案为:碳单质会与阳极产生的氧气反应而不断减少.
点评 本题考查物质的分离提纯和制备,为高频考点,侧重考查学生对化学工艺流程的理解、分析、判断及对知识的综合运用能力,涉及除杂、氧化还原反应、电解原理等知识点,明确化学反应原理、元素化合物性质是解本题关键,易错点是(6)题电极反应式的书写.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 这个反应是氧化还原反应 | B. | 制造过程中元素种类发生改变 | ||
| C. | 另一种化合物为NaCl | D. | 金刚石属于金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动.
郑州一中是一所具有丰厚的历史积淀、独特的精神内涵,以关注学生智慧与灵魂为学校文化内核,充满创新精神,能够培养具有国际视野的拔尖人才,拥有核心竞争力的国内名校.目前一中教育集团包含小学部、初中部、高中部三个学部的十余所学校.学校以主体课堂教学为载体,以培养学生的创新思维和实践能力为目标,在教学活动中特别注重学生科学素养的提升,如对于I A和ⅥA族重要元素化合物的性质,各校区根据实际情况开展了丰富多彩的探究活动. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钢铁制品的腐蚀常以析氢腐蚀为主 | |
| B. | 厨房中常用碳酸钠溶液洗涤餐具上的油污 | |
| C. | 明矾[KAl(SO4)2•12H2O]用于水的杀菌消毒 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 分子式 | 外观 | 沸点 |
| 高氯酸 | HClO4 | 无色液体 | 130℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com