
| A. | 加热,观察有无气体放出 | B. | 加入盐酸,观察有无气体放出 | ||
| C. | 加入澄清石灰水中观察有无沉淀 | D. | 加入CaCl2溶液观察有无沉淀 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 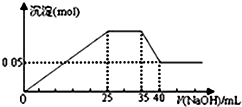 如图表示向含Mg2+、Al3+、NH4+的盐溶液中滴加NaOH溶液时,沉淀的量与NaOH的体积关系图.则三种离子的物质的量之比为:n(Mg2+):n(Al3+):n( NH4+)=2:1:2,其中使用的NaOH的浓度为2 mol•L-1 | |
| B. |  如图中曲线表示某反应过程的能量变化,当物质A(g)与B(g)反应生成物质C(g)是,△H>0,若使用正催化剂,E值会减小 | |
| C. | 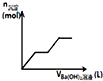 如图可用来表示向盐酸酸化的MgSO4溶液中加入Ba(OH)2溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2溶液体积(V)之间的关系图 | |
| D. | 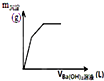 如图表示向一定质量的明矾溶液中滴加Ba(OH)2溶液时,产生沉淀的质量(m)与加入Ba(OH)2溶液体积(V)之间的关系图 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
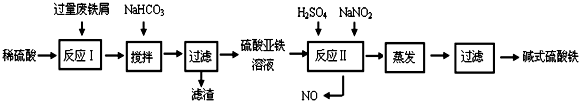
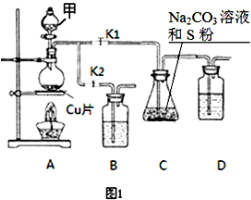 硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.
硫代硫酸钠(Na2S2O3)在工业生产、医药制造业中被广泛应用,工业普遍使用Na2SO3与硫磺(S)共煮得到,装置如图1.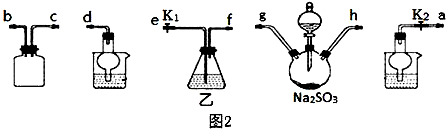
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥⑦ | B. | ②③④⑤⑦ | C. | ①④⑤⑥⑦ | D. | ①③⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Na+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6种离子都存在,则c(Cl-)>c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
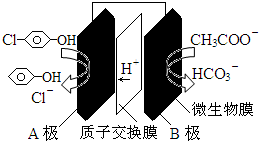
| A. | A极电极反应式为: +2e-+H+═ +2e-+H+═ +Cl- +Cl- | |
| B. | B极电极反应式为:CH3COO--8e-+4H2O═2HCO3-+9H+ | |
| C. | 溶液中的阴离子由A极向B极移动 | |
| D. | 该微生物电池在高温条件下无法正常工作 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 2mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 二氧化硫的催化氧化是放热反应,所以升高温度,反应速率减慢 | |
| D. | 汽车尾气中的CO和NO可以反应生成N2和CO2,在排气管中加催化剂可减小空气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com