
已知298
K,101 kPa时,2SO2(g)+O2(g) 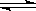 2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1
mol SO2,0.5 mol O2 和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1
mol SO2,0.5 mol O2 和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
A.Q2<Q1<197 kJ·mol-1 B.Q2=Q1=197 kJ·mol-1
C.Q1<Q2<197 kJ·mol-1 D.Q2=Q1<197 kJ·mol-1
A
【解析】
试题分析:反应的热化学方程式为:2SO2(g)+O2(g)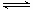 2SO3(g) △H=-197kJ/mol,由热化学方程式可知,在上述条件下反应生成1molSO3气体放热98.5kJ,加入2mol SO2和1molO2,生成的三氧化硫量小于1mol,所以Q1<197kJ。通入1mol SO2和0.5molO2,理论会生成1mol三氧化硫,放热0.5×98.5kJ,但是此时体系压强比加入2mol SO2和1molO2要小,所以平衡会向左移动,所以实际放出的热量<0.5×98.5kJ,即2Q2<Q1,综上得:2Q2<Q1<197kJ,答案选A。
2SO3(g) △H=-197kJ/mol,由热化学方程式可知,在上述条件下反应生成1molSO3气体放热98.5kJ,加入2mol SO2和1molO2,生成的三氧化硫量小于1mol,所以Q1<197kJ。通入1mol SO2和0.5molO2,理论会生成1mol三氧化硫,放热0.5×98.5kJ,但是此时体系压强比加入2mol SO2和1molO2要小,所以平衡会向左移动,所以实际放出的热量<0.5×98.5kJ,即2Q2<Q1,综上得:2Q2<Q1<197kJ,答案选A。
考点:考查反应热的计算
点评:该题是中等难度的试题,试题基础性强,注重答题的灵活性。有利于培养学生的逻辑推理能力和抽象思维能力。答题时注意浓度对平衡的影响以及可逆反应的特征。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
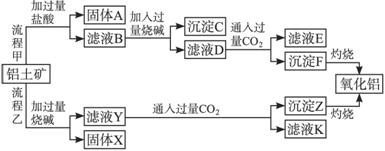
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为______________________________。
(2)流程乙加入烧碱后生成![]() 的离子方程式为_____________________________。
的离子方程式为_____________________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入_______________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是_______________(填化学式),写出该溶质的一种用途_______________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12。取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)=__________。
查看答案和解析>>
科目:高中化学 来源:2010届天津新华中学高三下学期第三次月考化学卷 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的方程式为 。
(2)流程乙加入烧碱后生成SiO32-的离子方程式为 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称)。
(4)滤液E中溶质的主要成份是 (填化学式),写出该物质的一种具体用途 。
(5)已知298 K时,Mg(OH)2的容度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+) = 。
查看答案和解析>>
科目:高中化学 来源:2015届重庆市高二上学期期中考试化学试卷(解析版) 题型:填空题
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下溶解平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
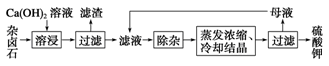
(1)滤渣主要成分有________和CaSO4以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。由图可得,随着温度升高,
① ,
② ,

③溶浸出的K+的平衡浓度增大。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32- CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=
。
CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K=
。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省石家庄市高三暑期第二次考试化学试卷(解析版) 题型:填空题
(6分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取两种工艺品的流程如下:
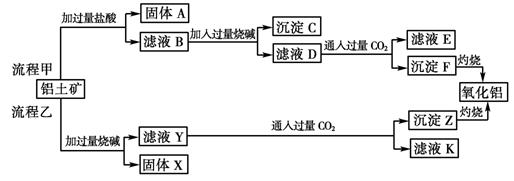
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后生成SiO32—的离子方程式为 。
(3)验证滤液B含Fe3+,可取少量滤液并加入 (填试剂名称)。
(4)滤液E、K中溶质的主要成份是 (填化学式),写出该溶液的一种用途
。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱达到沉淀溶解平衡,测得pH=13.00,则此温度下残留在溶液中的c(Mg2+)= 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省高三10月阶段测试化学试卷(解析版) 题型:填空题
(10分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:

请回答下列问题:
(1)流程甲通入过量CO2后生成沉淀F的离子反应方程式为______________________________________。
(2流程乙加入烧碱溶解SiO2的化学反应方程式____________________。
(3)验证滤液B含Fe3+,可取少量滤液并加入________(填试剂名称)。
(4)滤液E、K中溶质的主要成分是________(填化学式),写出该溶质的一种用途____________________。
(5)已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的滤液B,加入一定量的烧碱至达到沉淀溶解平衡,测得pH=12,则此温度下残留在溶液中的c(Mg2+)=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com