
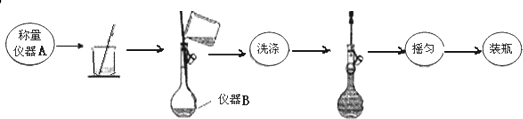
分析 (1)称取3.000g MgSO4样品,需要用到电子天平,配制250mL溶液需要250mL容量瓶;
(2)检验沉淀已经洗涤干净的方法是检验洗涤液中是否含有硫酸根离子来检验是否洗净;
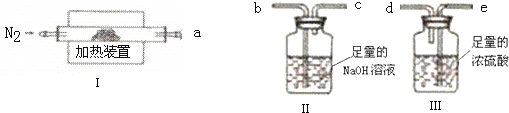
(3)实验目的是测定产品MgCO3•nH2O中的n值,需要测量水和二氧化碳的量,将气体通过洗气瓶进行洗气时,应该从长导管一侧通入气体;
(4)为了避免引起实验误差,保证反应产生的气体全部被装置C、D吸收,所以要通入N2排出装置内残留的气体,同时也是为了防止产生倒吸;
(5)若B装置中无残留物,通过装置D吸收的质量为生成水的质量,装置C吸收的是分解生成的二氧化碳的质量,据此计算物质的量得到n值.
解答 解:(1)称取3.000g MgSO4样品,需要用到电子天平,故A为电子天平,配制250mL溶液需要250mL容量瓶,故B为250mL容量瓶,“摇匀”的实验操作为把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀,
故答案为:电子天平;250mL容量瓶;把容量瓶瓶塞塞紧,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶上下颠倒摇动多次,使溶液混合均匀;
(2)检验碳酸镁晶体是否洗干净的方法是取最后一次洗涤液少许于试管,加入稀盐酸酸化,再加入几滴氯化钡溶液,若不再产生白色沉淀,则说明沉淀已洗干净,
故答案为:取最后一次洗涤液少许于试管,加入稀盐酸酸化,再加入几滴氯化钡溶液,若不再产生白色沉淀,则说明沉淀已洗干净;
(3)加热装置Ⅰ产生的气体二氧化碳和水蒸气依次通过浓硫酸和氢氧化钠溶液吸收,可以测定二氧化碳和水蒸气的量,故装置连接顺序为a→e、d→b,其中Ⅱ装置为碱性溶液吸收CO2以便测定样品中碳元素的含量,进而计算MgCO3•nH2O中的n值,
故答案为:a→e、d→b;吸收CO2以便测定样品中碳元素的含量;
(4)进行加热时还需通入N2的作用是将分解生成的气体全部带入装置Ⅱ或Ⅲ中,使其完全吸收,减少测定产生的误差,并防止倒吸,
故答案为:将分解生成的气体全部带入装置Ⅱ或Ⅲ中,使其完全吸收,并防止倒吸;
(5)若B装置中无残留物,通过装置D吸收的质量为生成水的质量,装置C吸收的是分解生成的二氧化碳的质量,b.装置C反应前后质量差m2 c.装置D反应前后质量差m3,可以计算,$\frac{{m}_{2}}{44}$:$\frac{{m}_{3}}{18}$=1:n,n=$\frac{22{m}_{3}}{9{m}_{2}}$,
故答案为:b、c;$\frac{22{m}_{3}}{9{m}_{2}}$.
点评 本题考查物质的组成的测定,主要考查对实验装置和实验流程的理解和熟悉实验操作,同时通过计算,确定水分子数.综合性较强,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
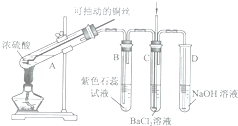 如图是某同学研究铜与浓硫酸的反应装置:
如图是某同学研究铜与浓硫酸的反应装置:| 实验装置 | 实验现象 |
 | 品红褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制氯化铁溶液时需加入少量盐酸 | |
| B. | 金属钠保存在装有煤油的带玻璃塞的广口瓶中 | |
| C. | 保存液溴需用水封,放在带橡皮塞子的棕色细口瓶中 | |
| D. | 用稀硝酸洗去附在试管内壁的银镜 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 反应时间min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 增大压强对正逆反应速率没有影响,平衡不移动 | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O(g),达到平衡时n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20mol H2O(g),与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大 | |
| D. | 由表格中数据得出,t1时刻该反应还未达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都有氧化反应发生 | |
| C. | 糖类、蛋白质都为高分子化合物 | |
| D. | 一氯甲烷、二氧化碳都是极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
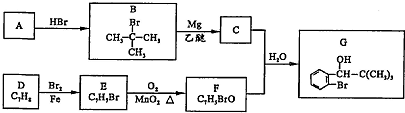
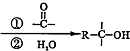
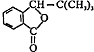
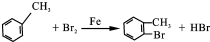 ,F的结构简式
,F的结构简式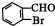 .
.
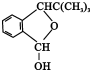 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期金属元素的化合价越高,元素的金属性越强 | |
| B. | 海轮外壳上附着一些锌块,可以减缓海轮外壳的腐蚀 | |
| C. | 在含有 BaSO4 沉淀的溶液中加入 Na2SO4固体,c(Ba2+) 增大 | |
| D. | 2NO(g)+2CO(g)═N2(g)+2CO2(g) 在常温下能自发进行,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④① | C. | ④③②① | D. | ②③①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com