
下列相关实验示意图不能达到实验目的的是

科目:高中化学 来源:2015届江苏省盐城市、建湖二中高一上学期期中联考化学试卷(解析版) 题型:选择题
鉴定NaCl的最佳方法是
A、焰色反应呈黄色,加硝酸酸化的AgNO3溶液有白色沉淀
B、焰色反应呈紫色,加盐酸酸化的AgNO3溶液有白色沉淀
C、焰色反应呈黄色,加盐酸酸化的AgNO3溶液有白色沉淀
D、焰色反应呈紫色,加硝酸酸化的AgNO3溶液有白色沉淀
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
(12分)金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
(1)工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为
;25℃,若调节溶液的pH=8,则溶液中残余Cr3+的物质的量浓度为 mol/L。(已知25℃时,Ksp[Cr(OH)3]=6.3×10-31)
(2)铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。
计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3+ + 3S2O82- + 7H2O Cr2O72- + 6SO42- + 14H+
Cr2O72- + 6SO42- + 14H+
②Cr2O72- + 6I- + 14H+ 2Cr3+ + 3I2 + 7H2O
2Cr3+ + 3I2 + 7H2O
③I2 + 2S2O32- 2I- + S4O62-
2I- + S4O62-
查看答案和解析>>
科目:高中化学 来源:2015届江苏省、常州一中、沭阳中学高三联合调研化学试卷(解析版) 题型:选择题
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是
A.CO2分子比例模型: B.NH4I的电子式:
B.NH4I的电子式:
C.乙烯的结构简式:C2H4 D.NaH中氢离子结构示意图为: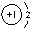
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:
Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是
Ni(CO)4(g),已知该反应平衡常数与温度的关系如下表,下列说法正确的是
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
A.上述生成Ni(CO)4的反应为吸热反应
B.25 ℃时,反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为2×10-5
Ni(s)+4CO(g)的平衡常数为2×10-5
C.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
D.80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时υ(正)>υ(逆)
查看答案和解析>>
科目:高中化学 来源:2015届江苏省泰州市姜堰区高二上学期中考试化学试卷(选修)(解析版) 题型:选择题
改变外界条件可以影响化学反应速率,对反应H2(g)+I2(g)  2HI(g),其中能使活化分子百分数增加的是:①升高体系的温度 ②增加反应物浓度 ③增大气体的压强 ④使用催化剂
2HI(g),其中能使活化分子百分数增加的是:①升高体系的温度 ②增加反应物浓度 ③增大气体的压强 ④使用催化剂
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:实验题
(10分)有机合成中常用的钯/活性炭催化剂若长期使用,会被铁、有机化合物等杂质污染而失去活性,成为废催化剂。一种由废催化剂制取PdCl2的工艺流程如下:
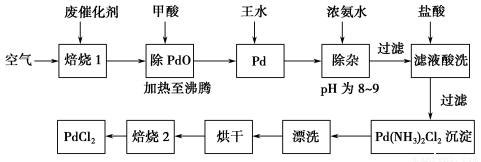
(1)“焙烧1”通入空气的目的是使有机化合物、活性炭等可燃物通过燃烧而除掉,通入空气过多反而不利于实现目的,其原因是 。
(2)甲酸在反应中被氧化为二氧化碳,写出甲酸与PdO反应的化学方程式: 。
(3)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是 (写化学式)。
(4)加入浓氨水的过程中,需要控制溶液的pH为8~9,实验室检测溶液pH的操作方法是: 。
(5)“焙烧2”的目的是: 。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三质量调研化学试卷(解析版) 题型:选择题
一种离子与多种酸根离子构成的盐称为“混盐”,如氯化硝酸钙[Ca(NO3)Cl];而“复盐”则是指含有多种简单阳离子和一种酸根阴离子的盐,如KAl(SO4)2。据此,下列各化合物中属于混盐的是
A.(NH4)2Fe(SO4) B.BiONO3 C.CaOCl2 D.K3[Fe(CN)6]
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.催化剂可以改变某反应的焓变
B.置换反应不一定是氧化还原反应
C.氨基酸溶液既显酸性又显碱性
D.催化剂不可能提高可逆反应中反应物的转化率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com