
| A. | 铜丝 | B. | NaCl | C. | 酒精 | D. | 蔗糖 |
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
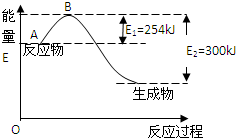 氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:
氮元素在地球上丰度较大,氮及其化合物用途广泛.请回答:| 化学键 | H-H | N≡N |
| 键能/( kJ/mol) | 435 | 943 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 反应至6min时,c(H2O2)=0.20mol/L | |
| B. | 反应至6min时,H2O2分解了40% | |
| C. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L•min) | |
| D. | 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com