

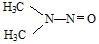 所示,1molNDMA分子中含有σ键的数目为10mol.
所示,1molNDMA分子中含有σ键的数目为10mol. 分析 (1)Co2+核外25个电子;
(2)配合物1Co(NH3)5Cl]Cl2中氮与氯离子提供孤对电子对与Co3+形成配位键,Co(NH3)5NO2]2+的配体中NH3中氮原子的杂化轨道类型为sp3,而NO2-中氮原子的杂化轨道类型为sp2;
(3)NO2-的电子数为24,其等电子体为O3;
(4)分子间形成氢键,溶解度增大;
(5)双键中一个π键、一个σ键;
解答 解:(1)Co2+核外25个电子,基态核外电子排布式为[Ar]3d7或1s22s22p63s23p63d7,故答案为:[Ar]3d7或1s22s22p63s23p63d7;
(2)配合物1Co(NH3)5Cl]Cl2中氮与氯离子提供孤对电子对与Co3+形成配位键,Co(NH3)5NO2]2+的配体中NH3中氮原子的杂化轨道类型为sp3,而NO2-中氮原子的杂化轨道类型为sp2,故答案为:N和Cl;sp2和sp3;
(3)NO2-的电子数为24,其等电子体为O3,故答案为:O3;
(4)H2O2与H2O之间可以形成氢键,溶解度增大,导致H2O2与H2O可以任意比例互溶,故答案为:H2O2与H2O之间可以形成氢键;
(5)双键中一个π键、一个σ键,1molNDMA中、结构简式如图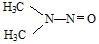 ,有6molC-H、2molC-N、1molN-N和1molN-Oσ键,共10molσ键,故答案为:10.
,有6molC-H、2molC-N、1molN-N和1molN-Oσ键,共10molσ键,故答案为:10.
点评 本题考查了物质结构和性质,涉及等电子体、核外电子排布式的应用等知识点,这些知识点都是高考热点,难度中等.


科目:高中化学 来源: 题型:实验题
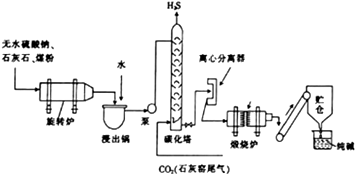 历史上路布兰法生产纯碱的工艺流程如图所示.
历史上路布兰法生产纯碱的工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水鉴别乙醇和溴苯 | |
| B. | 用红外光谱鉴别丙醛和1-丙醇 | |
| C. | 用溴水鉴别苯和正庚烷 | |
| D. | 用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol•L-1NaOH溶液500mL,根据溶液的配制情况,回答下列问题:
实验室需要0.1mol•L-1NaOH溶液500mL,根据溶液的配制情况,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com