

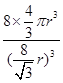 或
或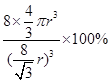
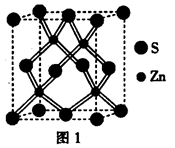
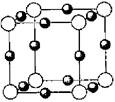
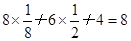 个,碳原子的半径为r,则碳原子所占的体积为V1=
个,碳原子的半径为r,则碳原子所占的体积为V1=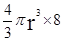 。设晶胞的边长为a,根据金刚石晶胞的结构,则
。设晶胞的边长为a,根据金刚石晶胞的结构,则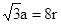 ,则
,则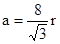 ,则晶胞的体积V=(
,则晶胞的体积V=(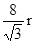 )3,则该晶体中B原子的空间占有率为:
)3,则该晶体中B原子的空间占有率为: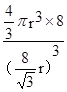 ×100%
×100%

科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
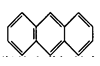 ,平面结构)属于________(填“极性”或“非极性”)分子。
,平面结构)属于________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

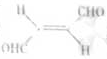 ,下列叙述正确的有 ⑤ 。
,下列叙述正确的有 ⑤ 。 键和1个
键和1个 键
键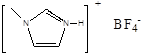 的熔点(填>、<或=),其原因是 ⑦
的熔点(填>、<或=),其原因是 ⑦查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com