
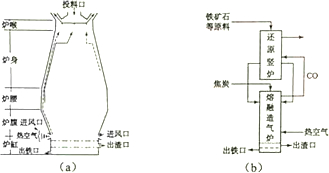
分析 (1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙;加入焦炭,先生成CO,最后生成二氧化碳;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)的△H,因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应.
解答 解:(1)铁矿石中含有氧化铁和脉石,为除去脉石,可加入石灰石,石灰石分解生成氧化钙,氧化钙和二氧化硅反应生成硅酸钙,涉及反应有CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3,加入焦炭,先生成CO,最后生成二氧化碳,尾气中含有CO,
故答案为:石灰石;CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3;CO;
(2)利用盖斯定律将①+②×3得到Fe2O3(s)+3C(s)+$\frac{3}{2}$O2(g)═2Fe(s)+3CO2(g)△H=(+494kJ•mol-1)+3×(-283kJ•mol-1)=-355kJ•mol-1,
因①为吸热反应,②③为放热反应,则②③反应放出的热量可使①反应,
故答案为:-355;②③;①;
(3)高炉炼铁时,炉腰部分发生Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,还原竖炉发生此反应,熔融造气炉和高炉的炉腹都发生2C+O2$\frac{\underline{\;高温\;}}{\;}$2CO以及CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,CaO+SiO2$\frac{\underline{\;高温\;}}{\;}$CaSiO3反应,则熔融造气炉相当于高炉的炉腹部分,
故答案为:炉腰;Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;炉腹;
(4)高炉气中混有SO2,SO2为酸性气体,可与碱反应,可用碱液或氢氧化钠、氨水等吸收,
故答案为:碱液或氢氧化钠、氨水.
点评 本题为2015年海南考题,涉及高炉炼铁,侧重于化学与生产的考查,综合考查元素化合物知识,有利于培养学生良好的科学素养,难度中等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
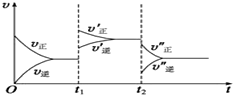 对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:
对于①N2(g)+3H2(g)??2NH3(g)△H<0 ②2NH3(g)?N2(g)+3H2(g)△H>0其中v-t图象为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| B. | 加入少量CH3COONa固体,平衡向正反应方向移动 | |
| C. | 加入水时,平衡向逆反应方向移动 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 2 | 4 | 6 | 8 |
| n(Cl2)/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
| A. | 保持其他条件不变,升高温度,平衡时c(Cl2)=0.022mol•L-1,则反应的△H<0 | |
| B. | 反应在前2s的平均速率v(CO)=0.015mol•L-1•S-1 | |
| C. | 保持其他条件不变,起始向容器中充入0.12molCOCl2和0.060molCl2、0.060 molCO,反应达到平衡前的速率:v正<v逆 | |
| D. | 保持其他条件不变,起始向容器中充入0.10molCl2和0.08molCO,达到平衡时,Cl2的转化小于60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 石蕊试液 | ||
| C. | 含酚酞的氢氧化钠溶液 | D. | 淀粉碘化钾试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
| A. | 等物质的量浓度的各溶液PH关系为:PH(Na2S)>PH(NaCN)>PH(CH3COONa) | |
| B. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(H+)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硅与氮的原子数之比为4:3 | |
| B. | 氮原子与硅原子间以共价键相结合 | |
| C. | 熔点高,硬度大,可用于制造柴油机 | |
| D. | amol氮化硅含有质子数的物质的量为70amol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9g甲基(-CH3)所含有的电子数是10 NA个 | |
| B. | 22.4L乙烷中含有的共价键数为7NA个 | |
| C. | 常温下,14g乙烯和丙烯的混合物中总原子数为3NA个 | |
| D. | 4.2g C3H6中含有的碳碳双键数一定为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com