
| X | Y | ||
| Z | M | R |
| A. | 元素的非金属性次序为:Y>X>M | |
| B. | 气态氢化物稳定性:M>R | |
| C. | Z的氧化物可以做光导纤维 | |
| D. | 最高价氧化物对应水化物的酸性:Y>X |
分析 由短周期元素在周期表的位置可知,X、Y处于第二周期,Z、M、R处于第三周期,R元素原子的最外层电子数等于电子层数的2倍,则R为S,可推知X为C元素,Y为N元素,Z为Al,M为P元素,结合元素周期律与元素化合物性质解答.
解答 解:由短周期元素在周期表的位置可知,X、Y处于第二周期,Z、M、R处于第三周期,R元素原子的最外层电子数等于电子层数的2倍,则R为S,可推知X为C元素,Y为N元素,Z为Al,M为P元素.
A.磷酸的酸性碳酸的强,故非金属性P>C,故A错误;
B.非金属性越强,气态氢化物越稳定,非金属性R>M,故氢化物稳定性:R>M,故B错误;
C.Z的氧化物为三氧化二铝,可以用作耐火材料,用作光导纤维的是二氧化硅,故C错误;
D.非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性Y>X,故最高价含氧酸酸性:Y>X,故D正确,
故选D.
点评 本题考查元素周期表及元素周期律的应用知识,题目难度不大,要熟记元素周期表中的递变规律,学以致用,掌握元素周期表结构.


科目:高中化学 来源: 题型:解答题
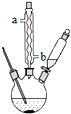 苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:
苯甲酸钠是一种常见的食品防腐剂.实验室制备苯甲酸的反应装置如图,有关数据如表:| 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | |
| 甲苯 | 92 | -94.9 | 110.6 | 难溶于水 |
| 苯甲酸 | 122 | 122.13 | 249 | 微溶于水 |
| 苯甲酸钠 | 144 | - | 249.3 | 易溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥⑦⑧ | B. | ②⑤⑥⑦⑨ | C. | ②④⑤⑥⑦⑧ | D. | ③④⑤⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
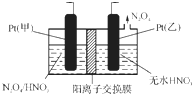 氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.
氮氧化物是造成雾霾天气的主要原因之一.消除氮氧化物有多种方法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
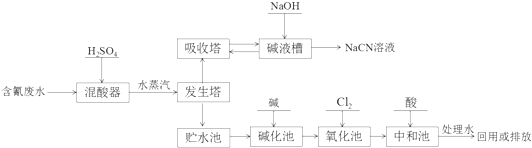
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
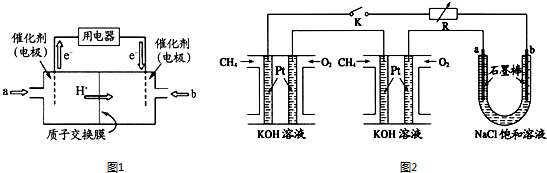
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
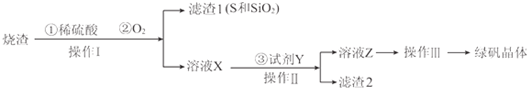
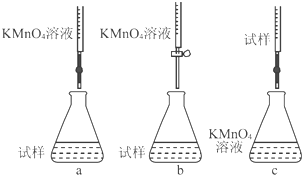
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
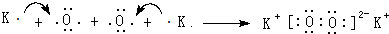 (用元素符号表示).
(用元素符号表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com