
【题目】(2分)N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量.则下列热化学方程中正确的是( )
A.![]() N2H4(g)+
N2H4(g)+![]() O2(g)=
O2(g)=![]() N2(g)+H2O(l)△H=+257kJmol﹣1
N2(g)+H2O(l)△H=+257kJmol﹣1
B.N2H4(g)+O2(g)=N2(g)+2H2O(l)△H=﹣133.5kJmol﹣1
C.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=+534kJmol﹣1
D.N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1
【答案】D
【解析】
试题分析:根据热化学方程式的意义以及热化学方程式的书写方法来写.
解;A、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,其焓变是负值,故A错误;
B、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,故B错误;
C、N2H4(g)完全燃烧生成氮气和气态水时,放出热量,其焓变是负值,故C错误;
D、0.25mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量,则1mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ×4=534kJ的热量,热化学方程式为:N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣534kJmol﹣1,故D正确.
故选D.


科目:高中化学 来源: 题型:
【题目】我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问题。
(1)Cu2+的未成对电子数有______个,H、O、S电负性由大到小的顺序为_______。
(2)在硫酸铜溶液中滴加过量氨水可形成[Cu(NH3)4]SO4蓝色溶液。[Cu(NH3)4]SO4中化学键类型有_______,阴离子中心原子杂化类型为______。
(3)铁铜合金晶体类型为_____;铁的第三(I3)和第四(I4)电离能分别为2957kJ/mol、5290kJ/mol,比较数据并分析原因________________。
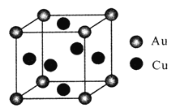
(4)金铜合金的一种晶体结构为立方晶型,如图所示。已知该合金的密度为dg/cm3,阿伏加德罗常数值为NA,两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为_______cm(写出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。下列说法正确的是
A. 1mol![]() Yb(镱)中含有的中子数为70NA
Yb(镱)中含有的中子数为70NA
B. 常温下,1LpH=13的Ba(OH)2溶液中由水电离的OH-数目为0.1NA
C. 在锌锰碱性电池中消耗13.0g负极材料,转移电子数为0.2NA
D. 常温常压下,28.0g丙烯和乙烯的混合气体中含有的氢原子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g) ===2H2O(l) ΔH=-571.66 kJ·mol-1
CO(g)+1/2O2(g) ===CO2(g) ΔH=-282.9 kJ·mol-1
若氢气与一氧化碳的混合气体完全燃烧可生成2.7 g H2O(l),并放出57.02 kJ热量,则混合气体中CO的物质的量约为( )
A. 0.22 mol B. 0.15 mol C. 0.1 mol D. 0.05 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐的成分为(NH4)2Fe(SO4)2·6H2O(M=392g·mol-1),常作氧化还原滴定剂。学校购买了一批摩尔盐样品(假设杂质不参与反应),某学习小组拟设计实验方案测定其纯度:
方案1:沉淀法。甲同学准确称量一定质量样品溶于适量的蒸馏水,滴加适量BaCl2溶液至S042-完全沉淀,经过滤、洗涤、干燥,称得BaSO4质量。
(1)检验SO42-是否完全沉淀的操作是____________________________________________。
方案2:滴定法。乙同学准确称取mg摩尔盐样品溶于蒸馏水配制成250mL溶液,量取25.00mL所配制溶液于锥形瓶中,滴加适量的稀硫酸,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液的体积为VmL。
(2)用KMnO4溶液滴定时应选用___(填“酸式”或“碱式”)滴定管,写出滴定反应的离子方程式:_________。
(3)该样品的纯度为_________________________________。
(4)若用待测液润洗锥形瓶,测得结果___________(填“偏高”“偏低”或“无影响”)。
方案3:量气法。丙同学准确称量4.0g样品按下图所示装置进行实验。

(5)①橡胶管L的作用是______________________。
②B中液体可以是___________(填字母)。
a.饱和食盐水 b四氯化碳 c.煤油 d饱和氯化铵溶液
③当A中样品完全反应后,待装置冷却至室温,测得NH3的体积为448mL(已折合成标准状况)。根据上述数据计算,该产品的纯度为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl,白色、易被氧化,Ksp=1.2×10-6)广泛用作催化剂、脱臭剂、脱色剂等。工业上用初级铜矿粉(主要含Cu2S、CuS、Fe2O3、FeO等)制备活性CuCl的流程如下:
(1)反应Ⅰ中Cu2S参与反应的化学方程式为:Cu2S+MnO2 + H2SO4→CuSO4 +S+MnSO4 + H2O(未配平);滤渣Ⅰ成分是:__________。

(2)除Mn2+时得MnCO3沉淀,该反应的离子方程式为_________________________。
(3)已知:Cu(OH)2可溶于氨水形成深蓝色溶液。
Cu(OH)2+4NH3![]() [Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
[Cu(NH3)4]2++2OH-。蒸氨条件及蒸氨效果见下表:
序号 | 温度/℃ | 时间/min | 压强/KPa | 残液颜色 |
a | 110 | 60 | 101.3 | 浅蓝色 |
b | 100 | 40 | 74.6 | 几乎很浅 |
c | 90 | 30 | 60.0 | 无色透明 |
由表中信息可知蒸氨的条件应选_______(填序号),请用平衡移动原理解释选择该条件的原因是________________________________。
(4)反应Ⅱ的离子方程式___________________________。
(5)实验证明通过如图装置也可获得CuCl,现象为
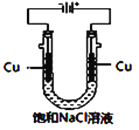
阴极:产生无色气体;
阳极:有白色胶状沉淀生成且逐渐增多;
U形管底部:靠近阴极区白色胶状沉淀逐渐转化为淡黄色沉淀。
①生成CuCl的电极反应式为________________________________。
②有同学提出:淡黄色沉淀可能是CuOH,以下是从资料中查阅到CuOH的有关信息,哪些不能支持该同学的说法________。(填序号)
a.容易脱水变成红色的Cu2O
b.CuOH是黄色或淡黄色固体,不溶于水
c.CuOH的Ksp=2×10-15
d.易被氧化成Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
B. 标准状况下,2.24LSO3中所含原子数为0.4 NA
C. 常温常压下,16gO2和O3的混合气体中所含原子数目为NA
D. 在一定条件下lmolN2与3molH2反应生成的NH3分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液: c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 含有AgCl和AgI固体的悬浊液: c(Ag+)>c(Cl-)=c(I-)
C. CO2的水溶液:c(H+)>c(HCO![]() )=2c(CO
)=2c(CO![]() )
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com