
| A. | 平衡后CO的体积分数为40% | |
| B. | 平衡后CO的转化率为25% | |
| C. | 平衡后水的转化率为50% | |
| D. | 平衡后混合气体的平均相对分子质量为24 |
分析 该反应前后气体的体积不变,平衡时水蒸气与H2的体积分数相等,说明平衡时水蒸气与H2的体积相等,二者体积都为10mL,据此可计算二者转化率,CO的体积分数;混合气体总质量不变,总的物质的量不变,则反应过程中混合气体的平均摩尔质量不变,结合气体体积之比等于物质的量之比计算平衡后混合气体的平均相对分子质量.
解答 解:该反应前后气体的体积不变,平衡时水蒸气与H2的体积分数相等,说明平衡时水蒸气与H2的体积相等,
设反应消耗CO的体积为xmL,则:
CO+H2O(g)?CO2+H2
xmL xmL xmL
故2mL-xmL=xmL,解得x=10mL,
A.平衡时CO的体积为:30mL-10mL-20mL,则CO的体积分数=$\frac{20mL}{30mL+20mL}$×100%=40%,故A正确;
B.平衡时CO的转化率=$\frac{10mL}{30mL}$×100%=33.3%,故B错误;
C.平衡时水的转化率=$\frac{10mL}{20mL}$×100%=50%,故C正确;
D.混合气体总质量不变,总的物质的量不变,平衡后平均相对分子质量等于反应前的平均相对分子质量,且相同条件下气体体积之比等于物质的量之比,则反应前CO和水的物质的量之比=30mL:20mL=3:2,其平均摩尔质量=$\frac{28×3+18×2}{3+2}$g/mol=24g/mol,所以平衡后混合气体的平均相对分子质量为24,故D正确;
故选B.
点评 本题考查化学平衡的有关计算,题目难度中等,根据方程式特征与氢气与水蒸气的体积关系确定二者物质的量相等是解题关键,注意掌握化学平衡及其影响因素,试题培养了学生的分析能力及化学计算能力..


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 11.1% | B. | 22.2% | C. | 33.3% | D. | 37.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
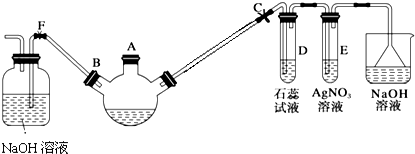
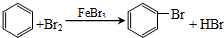 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
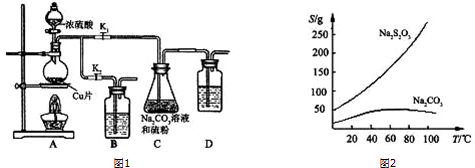
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.0% | B. | 14.3% | C. | 19.0% | D. | 66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com