
分析 (1)电子层越多,原子半径越大;同周期从左向右原子半径减小;
(2)非金属性越强,对应最高价含氧酸的酸性越强;金属性越强,最高价氧化物水化物的碱性越强;
(3)非金属性越强,对应氢化物越稳定.
解答 解:(1)电子层越多,原子半径越大;同周期从左向右原子半径减小,则原子半径为K>Ca,Si>N,
故答案为:>;>;
(2)非金属性越强,对应最高价含氧酸的酸性越强,则酸性的强弱:HNO3>H3PO4,金属性越强,最高价氧化物水化物的碱性越强,则碱性的强弱:Mg(OH)2>Al(OH)3;
故答案为:>;>;
(3)非金属性越强,对应氢化物越稳定,则氢化物的稳定性:H2S<H2O,NH3<HF,
故答案为:<;<.
点评 本题考查元素周期表和周期律的应用,把握元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Cl2>I2>Co2O3>Fe3+ | B. | Cl2>Co2O3>I2>Fe3+ | ||
| C. | Co2O3>Cl2>Fe3+>I2 | D. | I2>Fe3+>Cl2>Co2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.10 mol•L-1 NH4HCO3溶液中通CO2:c(NH4+)=c(HCO3-)+c(CO32-) | |
| B. | 向0.10 mol•L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH4+)>c(SO32-) | |
| C. | 向0.10 mol•L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)] | |
| D. | 向0.10 mol•L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | 试剂X | 离子方程式 |
| A | 透明溶液中:Fe3+、NH4+、SO42-、NO3- | 过量的铜粉 | 2Fe3++Cu=2Fe2++Cu2+ |
| B | Fe3+、Al3+、AlO2-、Cl- | 过量的盐酸 | AlO2+4H-=Al3++2H2O |
| C | Na、Ba2+、HCO3-、NO3- | NaHSO4溶液 | H-+HCO3=CO2↑+H2O |
| D | pH=0的溶液中:Mg2+,Fe2+、NO3-、SO42- | 双氧水 | 2Fe2++H2O2+2H-=2Fe3++2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-O-CH3 | B. | (CH3)3C-CH2-O-CH3 | ||
| C. | (CH3)3C-CH2-O-CH2-C(CH3)3 | D. | (CH3)2C=CH(CH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
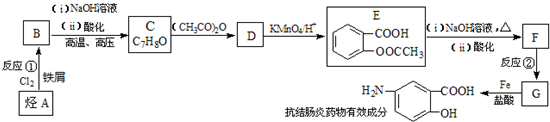
 $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$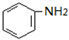 (苯胺易被氧化)
(苯胺易被氧化)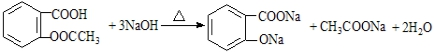 .
.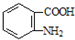 )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)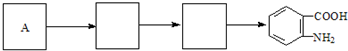
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和过量铁屑反应 3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 氯化铝溶液和过量的氨水反应 Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | 碳酸钠溶液中加入过量苯酚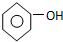 +CO32-→ +CO32-→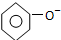 +HCO3- +HCO3- | |
| D. | 次氯酸钙溶液中通入过量CO2 ClO-+CO2+H2O═HClO+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未来化学的研究方向是经验化 | B. | 化学不需要再做实验 | ||
| C. | 化学不再是纯实验学科 | D. | 化学不做实验,就什么都不知道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com