

分析 以铜阳极泥(主要成分除含Cu、Te外,还有少量Ag和Au)为原料,加压硫酸浸出,得到浸出液的溶质溶质含有TeOSO4、CuSO4,通过电解除铜,在含碲硫酸铜母液中能SO2、及加氯化钠,得粗碲,
(1)①Ag2Te也能与O2发生类似Cu2Te的反应,结合Cu2Te与氧气反应的特点书写;
②工业上一般用压缩机加压给原料气加压;
(2)操作Ⅰ用于分离固体和液体;
(3)由操作Ⅰ可知分离出Ag、Au,则“含碲浸出液”的溶质含有TeOSO4、CuSO4;
(4)电解液含铜量逐渐减小,电解初始阶段阴极应生成铜;
(5)①TeOSO4与二氧化硫发生氧化还原反应生成Te;
②NaCl资源丰富,价格便宜;
③根据Te(IV)的浓度的变化计算还原率.
解答 解:(1)①Ag2Te也能与O2发生类似Cu2Te的反应,则与氧气反应生成Ag2O和TeO2,反应的化学方程式为2Ag2Te+3O2=2Ag2O+2TeO2,
故答案为:2Ag2Te+3O2=2Ag2O+2TeO2;
②工业上一般用压缩机加压给原料气加压,故答案为:用压缩机加压;
(2)操作Ⅰ用于分离固体和液体,为过滤操作,故答案为:过滤;
(3)由操作Ⅰ可知分离出Ag、Au,则“含碲浸出液”的溶质含有TeOSO4、CuSO4,故答案为:CuSO4;
(4)电解液含铜量逐渐减小,电解初始阶段阴极应生成铜,电极方程式为Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu;
(5)①TeOSO4与二氧化硫发生氧化还原反应生成Te,反应的化学方程式为Te4++2SO2+4H2O=Te+8H++2SO42-,
故答案为:Te4++2SO2+4H2O=Te+8H++2SO42-;
②NaCl比KI的资源丰富,价格便宜,所以工业生产时更节约成本,故答案为:NaCl比KI价格便宜;
③Te(IV)浓度从6.72g•L-1下降到0.10g•L-1,Te(IV)的还原率为$\frac{6.72-0.10}{6.72}$=98.5%,
故答案为:98.5%.
点评 本题为生产流程题,为高考常见题型和高频考点,涉及金属的回收、氧化还原反应、物质的分离提纯和除杂,侧重于学生的分析、计算能力的考查,题目较为综合,做题时注意仔细审题,从题目中获取关键信息.本题难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 4.0gCuO和Cu2S的混合物含铜离子个数为0.05NA | |
| B. | 标准状况下,11.2LC5H12蒸气所含甲基数目最多为NA | |
| C. | 0.5molK与O2完全反应生成K2O,K2O2,KO3的混合物,转移电子数为0.5NA | |
| D. | 1L 0.2mol•L-1HI溶液中含I-数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molKClO3所具有的总能量高于1molKCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1gKClO3,1gMnO2,0.1g Mn2O7混合加热,充分反应后MnO2质量为1g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
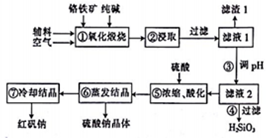 红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.
红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的化工原料,在印染、电镀等行业应用十分广泛.工业上以铬铁矿(主要成分为FeO•Cr2O3,还含少量SiO2)为原料制取红矾钠的流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
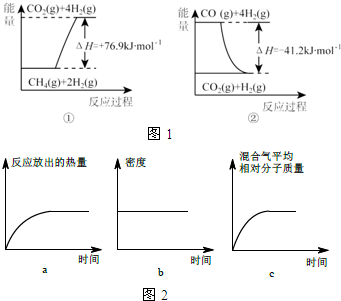 氨在国防、工农业等领域发挥着重要作用.
氨在国防、工农业等领域发挥着重要作用. | 15.2MPa | 20.3MPa | 30.4MPa |
| 400℃ | 32.8% | 38.8% | 48.2% |
| 450℃ | 22.4% | 27.5% | 35.9% |
| 500℃ | 14.9% | 18.8% | 25.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
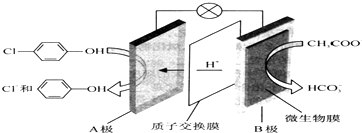
| A. | B为电池的正极,发生还原反应 | |
| B. | A极的电极反应式为: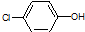 +e-=Cl-+ +e-=Cl-+ | |
| C. | 电流方向为从B极沿导线经小灯泡流向A极 | |
| D. | 当外电路中有0.2mole-转移时,通过质子交换膜的H+个数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2Se>H2S | B. | 原子半径:Se>O | ||
| C. | 酸性:H2SO4>H2SeO4 | D. | 还原性:Se2->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验亚硫酸钠试样是否变质:试样$\stackrel{溶解}{→}$$\stackrel{滴加硝酸钡溶液}{→}$白色沉淀$\stackrel{滴加稀盐酸}{→}$沉淀不溶解→说明试样已变质 | |
| B. | 检验某溶液中是否含有Fe2+:试样$\stackrel{滴加硫氰化钾}{→}$溶液颜色无变化$\stackrel{滴加氯水}{→}$溶液变红色→溶液中含有Fe2+ | |
| C. | 除去粗盐中含有的硫酸钙杂质:粗盐$\stackrel{溶解}{→}$$\stackrel{足量硝酸钠溶液}{→}$$\stackrel{足量氯化钡溶液}{→}$$\stackrel{过滤}{→}$$\stackrel{滤液中滴加盐酸}{→}$$\stackrel{蒸发结晶}{→}$精盐 | |
| D. | 证明酸性条件H2O2的氧化性比I2强:NaI溶液$\stackrel{30%过氧化氢、稀硝酸}{→}$$\stackrel{淀粉}{→}$溶液变紫色→氧化性:H2O2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
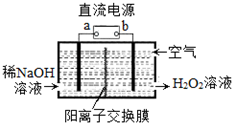 H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )
H2O2是一种常用绿色氧化剂,工业上利用电解法制备H2O2的装置如图所示,初始溶液为氢氧化钠溶液:下列说法正确的是( )| A. | a为负极 | |
| B. | 通入空气的电极反应式为O2+2e-+2H+═H2O2 | |
| C. | 电解一段时间后,左侧溶液pH降低 | |
| D. | 若生成17g双氧水,则有1molH+从左侧向右侧迁移 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com