
 以甲醇为原料,以KOH为电解质溶液的可充电的高效燃料电池,其电化学过程如图.
以甲醇为原料,以KOH为电解质溶液的可充电的高效燃料电池,其电化学过程如图.分析 (1)①充电时,原电池正极与电源正极相连;
②阳极上失电子发生氧化反应;
(2)放电时,负极上甲醇失电子发生氧化反应;
(3)乙池中A极上银离子得电子发生还原反应,根据转移电子相等计算氧气的体积;
(4)在常温常压下,8gCH3OH燃烧生成CO2和液态H2O时放热177.5kJ,则可以求出1mol甲醇完全燃烧生成二氧化碳和液态水放出的热量,再写出热化学方程式.
解答 解:(1)①充电时,原电池正极与电源正极相连,故答案为:正;
②阳极上氢氧根离子失电子发生氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑,
故答案为:4OH--4e-═2H2O+O2↑;
(2)放电时,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,所以电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-═CO32-+6H2O;
(3)乙池中B极上银离子得电子发生还原反应,当乙池中B极的质量升高216g,根据转移电子数相等,则甲池中理论上消耗O2体积=$\frac{\frac{216g}{108g/mol}×1}{4}$×22.4L/mol=11.2L,故答案为:11.2;
(4)在常温常压下,8gCH3OH燃烧生成CO2和液态H2O时放热177.5kJ,则1mol甲醇完全燃烧生成二氧化碳和液态水放热$\frac{177.5}{8}$×32=710.0KJ,所以甲醇燃烧的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-710.0kJ/mol,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l)△H=-710.0kJ/mol.
点评 本题考查了原电池和电解池原理,注意电极反应式的书写要结合电解质溶液的酸碱性,串联电路中转移电子相等.


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:解答题
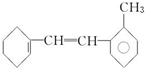 有机物结构简式如下:
有机物结构简式如下: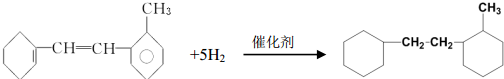 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、NO3-、CO32- | B. | Fe2+、Na+、SO42-、MnO4- | ||
| C. | K+、Mg2+、NO3-、SO42- | D. | Na+、Fe3+、Cl-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 11 | C. | 10 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ | B. | I2+SO2+2H2O=H2SO4+2HI | ||
| C. | H2O2+H2SO4=SO2+O2+2H2O | D. | 2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
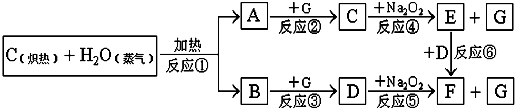
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蒸发操作时,当混合物中的晶体大部分析出时,才能停止加热 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体也从下口放出 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
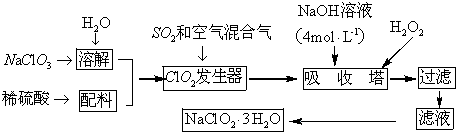
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com