
【题目】化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
2FeCl3+2HI===2FeCl2+I2+2HCl 2Co(OH)3+6HCl===2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH===2Fe(OH)3+2KI 3I2+6KOH===5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3===2KSCN+CO2↑+H2O KCN+CO2+H2O===HCN+KHCO3
热分解反应:
4NaClO![]() 3NaCl+NaClO4 NaClO4
3NaCl+NaClO4 NaClO4![]() NaCl+2O2↑
NaCl+2O2↑
下列说法不正确的是
A. 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 B. 还原性(碱性溶液):Fe(OH)2>I2>KIO3
C. 热稳定性:NaCl>NaClO4>NaClO D. 酸性(水溶液):HSCN>H2CO3>HCN
【答案】A
【解析】试题分析:A、在2FeCl3+ 2HI=2FeCl2+ I2+ 2HCl反应中,氧化性:FeCl3>I2,在2Co(OH)3+ 6HCl = 2CoCl2+ Cl2↑ + 6H2O中,氧化性:Co(OH)3>Cl2,又Cl2>FeCl3,故Co(OH)3>FeCl3,则有:Co(OH)3>FeCl3>I2,A错误;B、在 3I2+ 6KOH=5KI + KIO3+ 3H2O反应中,I2既是氧化剂又是还原剂,其还原性介于高低价态产物之间KI>I2>KIO3;在2Fe(OH)2+ I2+ 2KOH= 2Fe(OH)3+ 2KI反应中,反应物中作还原剂的是该反应中所有物质中还原性最强的,即Fe(OH)2>I2;Fe(OH)2>Fe(OH)3;Fe(OH)2>KI,故还原性应为:Fe(OH)2>I2>KIO3,B正确;C、物质分解时生成更加稳定的物质,在反应中4NaClO![]() 3NaCl + NaClO4,稳定性NaClO4>NaClO,在反应中NaClO4
3NaCl + NaClO4,稳定性NaClO4>NaClO,在反应中NaClO4![]() NaCl + 2O2↑中,稳定性NaCl>NaClO4,则稳定性NaCl>NaClO4>NaClO,C正确;D、化学反应遵循较强酸制弱较酸的规律,在反应2HSCN + K2CO3=" 2KSCN" + CO2 ↑ + H2O中,酸性HSCN>H2CO3,在反应中 KCN + CO2 + H2O=HCN + KHCO3,酸性H2CO3>HCN,则酸性为HSCN>H2CO3>HCN,D正确,答案选A。
NaCl + 2O2↑中,稳定性NaCl>NaClO4,则稳定性NaCl>NaClO4>NaClO,C正确;D、化学反应遵循较强酸制弱较酸的规律,在反应2HSCN + K2CO3=" 2KSCN" + CO2 ↑ + H2O中,酸性HSCN>H2CO3,在反应中 KCN + CO2 + H2O=HCN + KHCO3,酸性H2CO3>HCN,则酸性为HSCN>H2CO3>HCN,D正确,答案选A。


科目:高中化学 来源: 题型:
【题目】如图是一个化学过程的示意图,回答下列问题: 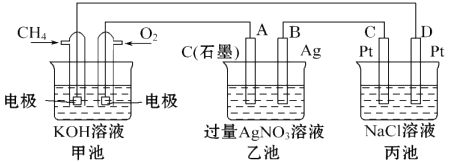
(1)甲装置中通入CH4的电极反应式为 ,
(2)从能量转化的角度分析,乙池是转化为的装置.
(3)一段时间,当丙池中产生112mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的物质的量浓度为 . (己知:NaCl溶液足量,电解后溶液体积为500mL).
(4)若要使丙池恢复电解前的状态,应向丙池中通入(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在pH=12的溶液中能大量共存的离子组是
A.Na+、K+、HSO3-、NO3-
B.Mg2+、ClO-、Na+、Cl-
C.Fe3+、Na+、SCN-、SO42-
D.MnO4-、NO3-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
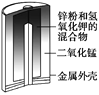
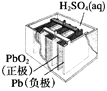
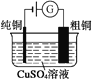
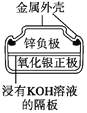
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是
A. 物质的量浓度之比为2∶1的NaClO、NaHSO3混合溶液中:c(HClO)+c(ClO-)=2c(HSO)+2c(H2SO3)+2c(SO![]() )
)
B. 物质的量浓度相等的① NH4HSO4溶液、② NH4HCO3溶液、③ NH4Cl溶液中,pH的大小关系:②>①>③
C. 常温下,pH=6的NaHSO3溶液中:c(SO![]() )-c(H2SO3)=9×10-7 mol·L-1
)-c(H2SO3)=9×10-7 mol·L-1
D. 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NaCl、FeCl2、FeCl3、MgCl2、AlCl3、NH4Cl六种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
A. 盐酸 B. 烧碱溶液 C. 氨水 D. KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解稀H2SO4、CuCl2的混合液,最初一段时间阴极和阳极上分别析出的物质分别是
A.H2和Cl2B.Cu和Cl2C.H2和O2D.Cu和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验在化学分析中有重要应用,现用浓度为0.1000molL-1酸性KMnO4标准溶液滴定未知浓度的草酸(H2C2O4):
(1)写出滴定过程中发生反应的离子方程式为 _____________________________________ 。
(2)滴定过程中操作滴定管的图示正确的是 _______________ 。
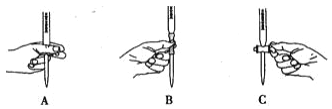
(3)若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果_____(选填:“偏大”、“偏小”或“不变”)。
(4)该滴定实验滴定终点的现象是_____________________________________ 。
(5)Na2Cr2O7可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被氧化所需要O2的质量)。现有某水样100.00 mL,酸化后加入C1 mol/L的Na2Cr2O7溶液 V1 mL,使水中的还原性物质完全被氧化(Cr2O72-还原为Cr3+);再用C2mol/L的FeSO4溶液滴定剩余的Cr2O72-,结果消耗FeSO4溶液V2 mL。量取一定体积的Na2Cr2O7溶液时,需要用______(酸式或碱式)滴定管;该水样的COD为___________________________mg/L;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com