
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 21.30 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.32 |
分析 (1)①滴定管用蒸馏水洗完后,必须润洗,不润洗滴定管,会使标准液的浓度减小;
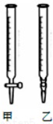
(2)甲是酸式滴定管,乙是碱式滴定管;
(3)A.锥形瓶有水,不影响滴定结果;
B.碱式滴定管尖嘴有气泡,消耗的标准液增大,结果偏高;
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗,无影响;
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失,待测液偏小,浓度偏低;
(4)滴定到溶液有无色变成浅红色时,且半分钟之内不再改变,到达滴定终点;
(5)先根据数据的有效性,舍去第1组数据,然后求出2、3组平均消耗V(NaOH),再计算出盐酸的浓度.
解答 解:(1)①滴定管用蒸馏水洗后,必须用氢氧化钠溶液润洗,故①操作有误;不润洗,标准液的浓度减小,消耗的体积增大,测定结果偏大,
故答案为:①;
(2)氢氧化钠为强碱,能与酸式滴定管玻璃活塞反应,应该用碱式滴定管,故选乙;
故答案为:乙;
(3)A.在锥形瓶装液前,留有少量蒸馏水,不影响待测液的物质的量,所以不影响滴定结果,故A错误;
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡,消耗的标准液增大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,滴定结果偏高,故B正确;
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗,不影响待测液的物质的量,无影响,故C错误;
D.用酸式滴定管量取液体时,释放液体前滴定管前端有气泡,之后消失,待测液偏小,消耗的标准液减少,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,滴定结果偏低,故D错误;
故选B;
(4)滴定终点现象是:锥形瓶中的溶液由无色变成浅红色,且半分钟内不再变化;
故答案为:由无色变成浅红色,且半分钟内不变色;
(5)三次滴定消耗的体积为:21.30mL,16.30mL,16.32,舍去第1组数据,两次消耗氢氧化钠溶液的体积为:16.30mL、16.32mL;平均值为 $\frac{16.30+16.32}{2}$=16.31(mL),c(HCl)=$\frac{n(NaOH)}{0.020L}$=$\frac{0.01631L×0.2000mol{L}^{-1}}{0.020L}$=0.1631mol/L,
故答案为:0.1631.
点评 本题考查酸碱中和滴定,涉及了滴定过程,误差分析,浓度求算等知识,注重基础知识考查,注意理解中和滴定的原理,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯、溴苯分子中的所有原子均共平面 | |
| B. | 在有机物分子中,含有的氢原子个数一定是偶数 | |
| C. | 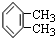 与 与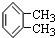 属于同种物质,说明苯分子中6个碳原子之间的键是完全一样的 属于同种物质,说明苯分子中6个碳原子之间的键是完全一样的 | |
| D. | CH2Cl2只有一种结构说明甲烷分子是正四面体结构,而不是平面正方形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 、B
、B .
. +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O,
+NaCl+H2O, +2Cl2→
+2Cl2→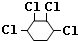 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为Mg-2e-═Mg2+ | |
| B. | 正极反应式为Ag+e-═Ag | |
| C. | 电池放电时Cl-由负极向正极迁移 | |
| D. | 负极会发生副反应Mg+2H2O═Mg(OH)2+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3Q1+3Q2<2Q3 | B. | Q1+Q2<Q3 | C. | 3Q1+Q2<6Q3 | D. | 3Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
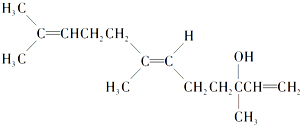
| A. | 既能发生取代反应,也能发生加成反应 | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 1mol橙花醇在氧气中充分燃烧,需消耗448 L氧气(标准状况) | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗3mol溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
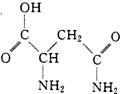 芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.| 编号 | I5/kJ•mol-1 | I6/kJ•mol-1 | I7/kJ•mol-1 | I8/kJ•mol-1 |
| A | 6990 | 9220 | 11500 | 18700 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com