
����Ŀ����������HNO2��ΪһԪ���������������������ơ���֪��298Kʱ���������ʵĵ���ƽ�ⳣ����K�����±���
HNO2 | NH3��H2O | H2CO3 | H2SO3 | |
K��mol��L-1��-2 | 5.1��10-4 | 1.8��10-5 | Ka1=4.2��10-7 Ka2=5.61��10-11 | Ka1=1.3��10��2 Ka2=6.3��10��8 |
��1�����в���˵��HNO2��������ʵ���_____��
A.������0.1 mol��L-1 NaNO2��Һ��pH��7
B.��һ��Ũ��HNO2��Һ������ʵ�飬���ݺܰ�
C.��pH��������������HNO2��Һ�ֱ�������п��Ӧ��HNO2�ų��������϶�
D.�����£�0.1mol��L-1 HNO2��Һ��pH=2.3
��2��298Kʱ����10mL 0.1mol��L-1����������Һ��10mL 0.1mol��L-1��ˮ��ϣ�������ҺΪ_____���������ԡ�������������������������ԭ����___________________________��
��3������pH=2��HNO2��HCl����Һ�ֱ��ˮϡ����pH�仯����ͼ��ʾ���ж�����I��Ӧ����ҺΪ_______���ѧʽ����ͼ��a��b��c�����Ӧ��Һ�ĵ���������ǿ������˳����
________����a��b��c��ʾ����ͬ������Һ��ˮ�ĵ���̶���ǿ������˳����________��

��4�������ṩ���ݻش��������⡣
����298Kʱ��NaHSO3��Һ��HSO3-ˮ��ƽ�ⳣ��Kh =____���ɴ˿��ж�HSO3-ˮ��̶�______����̶ȣ����������������������
��H 2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪ______��
��5��298Kʱ������2mol Na2CO3����Һ�м���1mol��HNO2������Һ��CO32-��HCO3-��NO2-������Ũ���ɴ�С��_______��
���𰸡� B ���� ��Ӧǡ�����ɵ�������泥������������ˮ��ʼ��ԣ�笠�����ˮ������ԣ����������������ˮ��̶�С��笠����ӣ��ʳ����� HCl b>a>c c > a > b 7.7��10��13 �� H2SO3��HCO![]() =HSO
=HSO![]() ��CO2����H2O [HCO3-]��[NO2-]��[CO32-]
��CO2����H2O [HCO3-]��[NO2-]��[CO32-]
����������1��A��NaNO2��ҺpH��7����NaNO2Ϊ����ǿ���Σ�˵��HNO2��������ʣ���A����B�����ݺܰ�ֻ��˵������Ũ��С��Ũ��С��ǿ�������Һ������Ҳ�����������������ʵ�ǿ���أ���B��ȷ��C����pH��������������HNO2��Һ�ֱ�������п��Ӧ��HNO2�ų��������϶࣬˵��HNO2��Һ���ڴ���δ�����HNO2���ӣ���HNO2Ϊ������ʣ���C����D��0.1mol/L����������Һ��pHԼΪ2.3���������Ჿ�ֵ��룬˵��HNO2��������ʣ���D����ѡB��
��2����10mL 0.1mol��L-1����������10mL 0.1mol��L-1��ˮ��ϣ�ǡ����ȫ��Ӧ����NH4NO2�������������ˮ��ʼ��ԣ�笠�����ˮ������ԣ��ɱ����֪HNO2�ĵ��볣������NH3��H2O�ĵ��볣�����������������ˮ��̶�С��笠����ӣ���Һ�����ԡ�
�ʴ�Ϊ����������Ӧǡ�����ɵ�������泥������������ˮ��ʼ��ԣ�笠�����ˮ������ԣ����������������ˮ��̶�С��笠����ӣ��ʳ����ԡ�
��3��HNO2�����ᣬ���ֵ��룬pH=2��HNO2���д���δ�����HNO2������Һ��ˮϡ����ͬ�ı�����HNO2��pH�仯��С��������I��Ӧ����ҺΪHCl����Һ�ĵ���������������Ũ�ȴ�С�йأ�Ũ��Խ��������Խǿ������pH��֪��a��b��c�����Ӧ��Һ��������Ũ�ȴ�С˳��Ϊ��b��a��c�����Ե���������ǿ������˳����b��a��c�����ˮ�ĵ������������ã�����������Ũ��ԽС����������ԽС����ˮ�ĵ���̶�Խ��������Һ��ˮ�ĵ���̶���ǿ������˳����c > a > b��
�ʴ�Ϊ��HCl��b��a��c��c > a > b��
��H2SO3һ������Ϊ��H2SO3HSO3-+H+��Ka1=1.3��10��2��HSO3-��ˮ��HSO3-+H2OH2SO3+OH-��Kh=Kw/Ka1=10��14/1.3��10��2=7.7��10��13��HSO3-�ĵ��볣��ΪKa2=6.3��10��8��Ka2��Kh����HSO3-��ˮ��̶�С�ڵ���̶ȡ�
�ʴ�Ϊ��7.7��10��13 ���� ��
�ڸ��ݵ��볣���ɵ�����ǿ��˳��H2SO3��H2CO3��HSO3-��HCO3-������ǿ��������ԭ����H 2SO3��Һ��NaHCO3��Һ��Ӧ������CO2��HSO3-�����ӷ���ʽΪ��H2SO3��HCO3-=HSO3-��CO2����H2O��
�ʴ�Ϊ��H2SO3��HCO3-=HSO3-��CO2����H2O��
�۸��ݵ��볣����֪������ǿ��HNO2��H2CO3��HCO3-������2mol Na2CO3����Һ�м���1molHNO2����ʽΪ��Na2CO3��HNO2=NaHCO3��NaNO2��ʣ��1molNa2CO3����������Һ����Ϊ1molNaNO2��1molNaHCO3��1molNa2CO3����Ϊ����HNO2��H2CO3��HCO3-������CO32-��ˮ��̶ȴ���NO2-��ˮ��̶ȣ�����n(CO32-)��n(NO2-)��1mol��HCO3-���볣��Ka1=5.61��10-11��ˮ�ⳣ��Kh=10-14/4.2��10-7����HCO3-��ˮ����ڵ��룬CO32-��ˮ��̶ȴ���HCO3-��ˮ��̶ȣ���CO32-ˮ������HCO3-������n(HCO3-)��1mol������Һ��CO32-��HCO3-��NO2-
�ʴ�Ϊ��c(HCO3-)��c(NO2-)��c(CO32-)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��W��Q��Ԫ�����ڱ��е����λ����ͼ��ʾ������˵����ȷ���ǣ� ��
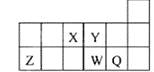
A. ԭ�Ӱ뾶�Ĵ�С˳��Ϊ��rX��rY��rZ��rW��rQ
B. ����Y2����Z 3���ĺ���������͵��Ӳ���������ͬ
C. Ԫ��W��Q������������Ӧ��ˮ���������W��ǿ
D. Ԫ��X��Ԫ��Z����������ϼ�֮�͵���ֵ����8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ��������ʯ����̿��������ʯ��ʯΪԭ����ұ������
��1����д���ô������ڸ�����ұ�����Ļ�ѧ����ʽ___________�������û�ѧ�������ʵ�鷽������������Ӧ�õ��Ĺ�������к�������___________��
��2��С��ͬѧ����ұ�����õ����۰���ͼװ�����Ʊ� Fe(OH)2��ʵ�鿪ʼʱӦ��_______����a��___________���� b(����رա�)

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20 mL 0.5 mol��L-1�Ĵ�����Һ����μ�������ʵ���Ũ�ȵ��ռ���Һ,�ⶨ�����Һ���¶ȱ仯��ͼ��ʾ�����й��ڻ����Һ�����˵���д������
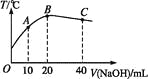
A. ����ĵ���ƽ�ⳣ��:B��>A��
B. ��ˮ�������c(OH-):B��>C��
C. ��A�㵽B��,�����Һ�п��ܴ���:c(CH3COO-)=c(Na+)
D. ��B�㵽C��,�����Һ��һֱ����:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.����������һ���Ǽ���������
B.����������һ���ǽ���������
C.�ǽ���������һ��������������
D.����������һ���Ƿǽ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���û���̿��ԭ������������йط�ӦΪC(s)+2NO(g) ![]() N2(g)+CO2(g)��
N2(g)+CO2(g)��
��1��д��������Ӧ��ƽ�ⳣ������ʽ_______________��
��2����2L�����ܱ����м�������C��NO������Ӧ����������������ش��������⡣
ʵ���� | �¶�/�� | ��ʼʱNO�����ʵ���/mol | ƽ��ʱN2�����ʵ���/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
����ϱ������ݣ��жϸ÷�Ӧ�ġ�H____0(����������������)��������_________��
���жϸ÷�Ӧ�ﵽƽ���������_______��
A.�����������ܶȺ㶨 B.�����ڸ�����Ũ�Ⱥ㶨
C.������ѹǿ�㶨 D.2v����NO��= v�棨N2��
��3��700��ʱ������2L����㶨���ܱ������г���һ����N2��CO2������Ӧ��N2(g)+CO2(g)![]() C(s)+2NO(g) ������N2��NO���ʵ�����ʱ��仯����������ͼ��ʾ����ش��������⡣
C(s)+2NO(g) ������N2��NO���ʵ�����ʱ��仯����������ͼ��ʾ����ش��������⡣
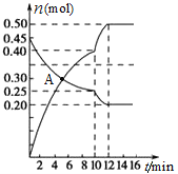
��0��10 min�ڵ�CO2ƽ����Ӧ����v��____________��
��ͼ��A��v(��)___v(��)�����������������������
�۵�10 minʱ�����ı������������_____________��
A���Ӵ��� B������C�����ʵ���
C����СCO2�����ʵ��� D������ E������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������̼�����¸�������ͬ��������IJ��ϸ��죬���ڲ���˵����ȷ����
A. ��̥���й̶����۵� B. �����Ͻ������Ƴ���ʹ��������
C. ʹ�õ�̼��ά���ڽ������� D. �������Ƶ��л������ǹ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ���Լ����O2���ɵ�ȼ�ϵ�ص��AlCl3��Һ��װ�ã��缫���Ͼ�Ϊʯī���ø�װ�ý���ʵ�飬��Ӧ��ʼ��۲쵽x�缫�������ְ�ɫ����������˵����ȷ����(����)

A. ԭ����е������Һ��pH����
B. �����е��AlCl3��Һ���ܷ�ӦΪ2Cl����2H2O![]() Cl2����H2����2OH��
Cl2����H2����2OH��
C. M��ͨ�������ΪCH4���缫��ӦʽΪCH4��10OH����8e��===CO![]() ��7H2O
��7H2O
D. ������Cl����x���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.���Ӿ����ж����ڹ��ۼ�B.�ڵ��ʵľ�����һ��������������
C.���Ӿ�����ֻ�����Ӽ�D.�ɱ��ͱ�����������ȫ��ͬ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com