
| A. | 氯化铁溶液 溴水 | B. | 碳酸钠溶液 溴水 | ||
| C. | 酸性高锰酸钾溶液 溴水 | D. | 酸性高锰酸钾溶液 氯化铁溶液 |
分析 己烯、甲苯、乙酸乙酯、苯酚溶液,先加溴水,溴水褪色的为己烯,生成白色沉淀的为苯酚;现象相同的甲苯、乙酸乙酯,然后另取两种液体少许,分别滴加高锰酸钾,褪色的为甲苯,出现分层的为乙酸乙酯,以此来解答.
解答 解:A.氯化铁溶液能鉴别苯酚,现象是溶液变为紫色,溴水能鉴别己烯、苯酚,现象分别是褪色和生成白色沉淀三溴苯酚,但不能鉴别甲苯和乙酸乙酯,故A错误;
B.溴水能鉴别己烯、苯酚,现象分别是褪色和生成白色沉淀三溴苯酚,碳酸钠溶液、溴水都不能鉴别甲苯和乙酸乙酯,故B错误;
C.溴水能鉴别己烯、苯酚,现象分别是褪色和生成白色沉淀三溴苯酚,酸性高锰酸钾溶液能与甲苯发生氧化还原反应而褪色,与乙酸乙酯不反应,故C正确;
D.酸性高锰酸钾不能鉴别己烯和甲苯,二者都能使酸性高锰酸钾溶液褪色,氯化铁只能鉴别苯酚,故D错误.
故选C.
点评 本题考查有机物的鉴别,为高频考点,侧重有机物性质及鉴别方法的考查,把握有机物的官能团与性质及反应的不同现象为鉴别的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
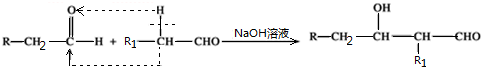
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 组 分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |
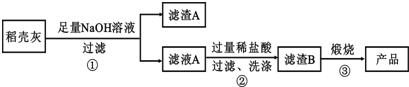
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K |
| 973K | 1.47 |
| 1173K | 2.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
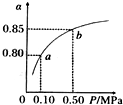 已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.50mol A和0.25mol B,在500℃时充分反应,达平衡后测得c(C)=0.4mol•L-1,放出热量Q1 kJ.
已知2A(g)+B(g)?2C(g),向容积为1L的密闭容器中加入0.50mol A和0.25mol B,在500℃时充分反应,达平衡后测得c(C)=0.4mol•L-1,放出热量Q1 kJ.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 内容 | NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 |
| A | 发生水解 | 无银镜反应 | 不反应 | 不反应 |
| B | 发生中和反应 | 无银镜反应 | 溶解 | 放出H2 |
| C | 不反应 | 有银镜反应 | 有红色沉淀 | 放出H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.3 mol•L-1 的NH4NO3溶液中含有的NO-3数目为0.3NA | |
| B. | 常温常压下,5.6gC2H4和C3H6的混合气体中含氢原子数为0.9NA | |
| C. | 将标准状况下11.2L的Cl2通入足量水中,转移的电子总数为0.5NA | |
| D. | 一定量的Fe与含1 mol HNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com