
| 0.01mol-0.001mol |
| 1L |
| Ksp |
| c(Ba2+) |
| 1.08×10-10 |
| 0.009 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgI比AgCl稳定 |
| B、碘氧化性比氯弱 |
| C、I-的还原性比Cl-强 |
| D、溶度积Ksp(AgI)<Ksp(AgCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是一种试验某气体化学性质的实验装置,图中B为开关. 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )
如图是一种试验某气体化学性质的实验装置,图中B为开关. 如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶中盛有的溶液是( )| A、浓H2SO4 |
| B、饱和NaCl溶液 |
| C、浓NaOH溶液 |
| D、饱和Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、m+n>p |
| B、A的转化率降低 |
| C、平衡向正反应方向移动 |
| D、C的质量分数增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
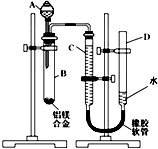 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O比Na2O2稳定 |
| B、均可与CO2、H2O反应产生氧气 |
| C、Na2O是淡黄色固体,而Na2O2是白色固体 |
| D、阴阳离子个数比均为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com