
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法中正确的是()。
A.A、B、C三点溶液的pH:C<A<B
B.A、B、C三点醋酸的电离程度:A<B<C
C.用湿润的pH试纸测量A处溶液的pH,测量结果偏小
D.A、B、C三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:C<A<B

 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)德国人哈伯在1913年实现了合成氨的工业化生产,反应原理:
N2(g)+3H2(g) 2NH3(g);已知298 K时,
ΔH=-92.4 kJ·mol-1,ΔS=-198.2J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。
(2)如图在一定条件下,将1 mol N2和3mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图:
则阴极的电极反应式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012届高考化学一轮复习《化学反应速率与化学平衡》专题综合测试(苏教版) 题型:填空题
(8分)德国人哈伯在1913年实现了合成氨的工业化生产,反应原理:
N2(g)+3H2(g) 2NH3(g);已知298 K时,
2NH3(g);已知298 K时,
ΔH=-92.4 kJ·mol-1,ΔS=-198.2 J·mol-1·K-1,试回答下列问题:
(1)计算说明298 K下合成氨反应能否自发进行?________(填“能”或“不能”);在298 K时,将10 mol N2和30 mol H2放入合成塔中,为什么放出的热量小于924 kJ?________。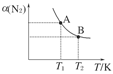
(2)如图在一定条件下,将1 mol N2和3 mol H2混合于一个10 L的密闭容器中,反应达到A平衡时,混合气体中氨占25%,试回答下列问题:
①N2的转化率为________;
②在达到状态A时,平衡常数KA=________(代入数值的表达式,不要求得具体数值),当温度由T1变化到T2时,KA________KB(填“=”、“<”或“>”)。
③在达到状态B时,下列说法正确的是( )
a.通入氩气使压强增大,化学平衡向正反应方向移动
b.N2的正反应速率是H2的逆反应速率的1/3倍
c.降低温度,混合气体的平均相对分子质量变小
d.增加N2的物质的量,H2的转化率降低
(3)若在恒温、恒压条件下合成氨反应达到平衡后,再向平衡体系中通入氩气,平衡________移动(填“向左”“向右”或“不”)。
(4)在1998年希腊亚里斯多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温高压下高转化率的电化学合成氨,其实验装置如图: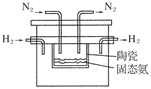
则阴极的电极反应式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省黄冈市高三3月质量检测理综化学试卷(解析版) 题型:选择题
单质碳和氧化铜在一定温度下反应时,氧化铜可被还原为Cu2O、Cu。现将2.00g C与 16.0g CuO的混合物,隔绝空气加热一段时间后,将生成的气体通过足量的澄淸石灰水,共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法错误的是
A.反应后的固体混合物中还含有碳
B.反应后的固体混合物中Cu的质量为12.8 g
C.反应后的固体混合物总质貴为14.4 g
D.反应后的固体混合物中氧化物的物质的量为0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原-氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlC13(g)+3C(s) =3AlCl(g)+3CO(g) △H=a kJ·mol-1
3AlCl(g)=2Al(l)+AlC13(g) △H=b kJ·mol-1
①反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b 的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3 与盐酸反应(产物之一是含氢量最高的烃) 的化学方程式为 。
 (2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
(2)镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al122+17H2=17MgH2+12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是 。
②在6. 0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17 Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2 的物质的量为 。
 ③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 图8
③在0. 5 mol·L-1 NaOH 和1. 0 mol·L-1 MgCl2溶液中, 图8
混合物Y 均只能部分放出氢气,反应后残留固体物质的X-射线衍射谱图如图8 所示(X-射线衍射可用于判断某晶态物
质是否存在,不同晶态物质出现衍射峰的衍射角不同)。在上述NaOH 溶液中,混合物Y 中产生氢气的主要物质是
(填化学式)。
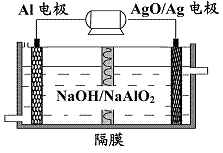
(3)铝电池性能优越,Al-AgO 电池可用作水下动力电源,
其原理如图9所示。该电池反应的化学方程式为 。
图9
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com