
下列对有关实验事实的解释正确的是
A.向某溶液中滴加氯水后,再加入KSCN溶液,溶液呈红色,说明原溶液中含有Fe2+
B.浓硫酸和浓盐酸长期暴露在空气中浓度均降低,原理不相同
C.向某溶液中加入氯化钡溶液,生成白色沉淀,再加入稀盐酸,沉淀不溶解,则原溶液一定含有SO42
D.常温下,浓硫酸可以用铁质容器储运,说明铁与冷的浓硫酸不反应
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源:2014-2015学年陕西省安康市高三上学期第二次教学质量调研化学试卷(解析版) 题型:填空题
(12分)碱式碳酸锌【xZnCO3·yZn(OH) 2·zH2O】主要用做橡胶硫化促进剂,工业上利用锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)生产碱式碳酸锌的工艺流程如下:
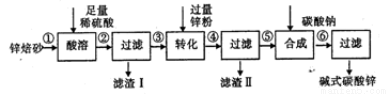
请回答下列问题:
(1)向锌焙砂加入足量稀硫酸进行酸溶的过程中,所发生反应的离子方程式为 、___ _(写其中任意两个)。
(2)从滤渣I中分离出SiO2的部分流程如下:
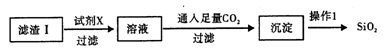
①试剂X的名称为____ 。②操作1的方法为________ 。
(3)加入锌粉的目的是____ ,从滤渣Ⅱ中获取铜的操作方法为 。
(4)高温煅烧碱式碳酸锌得到ZnO,取碱式碳酸锌3.41g,在高温下煅烧至恒重,得到固体2.43g和标准状况下CO2 0.224L,则该碱式碳酸锌的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:填空题
20.(12分)Zn?MnO2干电池应用广泛,其电解质溶液是ZnCl2—NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是_________ ___。若电解电路中通过2 mol电子,MnO2的理论产量为________g。
查看答案和解析>>
科目:高中化学 来源:2014-2015江苏省盐城市高二12月月考化学试卷(解析版) 题型:选择题
4.下列电离方程式中正确的是
A.NaHCO3溶于水:NaHCO3=Na++H++CO32-
B.NaHSO4熔化:NaHSO4=Na++H++SO42-
C.HF溶于少量水中:2HF H++HF2一
H++HF2一
D.(NH4)2 SO4溶于水:(NH4)2 SO4=2NH4++SO42一
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:填空题
(19分)某化学课外兴趣小组为探究铜与浓硫酸的反应,用下图所示的装置进行实验:


请回答下列问题:
(1)B是用收集实验中产生气体的装置,但未将导管画全,请将装置图补充完整。
(2)实验中他们取6.4g铜片和12mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应停止,最后发现烧瓶中还有铜片剩余,该小组中的同学认为还有一定量的硫酸剩余。
①写出铜与浓硫酸反应的化学方程式:_________________________________________;
实验中若有m g铜参加了反应,则有______mol硫酸被还原,电子转移数目为___。
②下列试剂中,能证明反应停止后烧瓶中有硫酸剩余的是__________(填写字母编号)。
A.硫酸钠溶液 B.氯化钡溶液 C.银粉 D.碳酸钠溶液
③为什么有一定量的硫酸剩余但未能使铜片完全溶解?你认为的原因是
__________________________________________________________________。
(3)为了测定消耗硫酸的物质的量,该兴趣小组设计了两个实验方案:
方案一:将装置A产生的气体缓缓通过已称量过的装有碱石灰的干燥管,反应停止后再次称量,两次质量差即是吸收的二氧化硫。
方案二:将装置A产生的气体缓缓通入足量的用硫酸酸化的高锰酸钾溶液,再加入足量的氯化钡溶液,过滤、洗涤、干燥,称得沉淀的质量即是二氧化硫转化为硫酸钡沉淀的质量。
实际上,方案一、二均不可取。
方案一产生的气体中含有 ,使干燥管增重偏大;也可能由于
,使干燥管增重偏小。
方案二:由于 与氯化钡溶液反应,使测定消耗硫酸的物质的量结果偏大。
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.常温、常压下,16 g O3中含有的氧原子数为
B.7.8 g Na2O2与水充分反应,转移的电子数为0.2 NA
C.0.1 mol Fe与0.1 mol Cl2充分反应,转移的电子数为0.3NA
D.标准状况下,11.2 L H2O中含有的氢原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列物质的俗称、主要成分的化学式及其用途均正确的是
A.磁铁矿——Fe2O3——炼铁 B.胆矾——CuSO4·5H2O——波尔多液
C.蓝宝石——SiO2——饰品 D.纯碱——NaHCO3——焙制糕点
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都郫县高三第二次阶诊断性考试理综化学试卷(解析版) 题型:填空题
(18分)A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数相同,B位于元素周期表的S区。C元素原子的外围电子层排布式为nsn—1npn—1。D原子M能层为全充满状态,且最外层无成对电子,E的化合物种类最多。请回答下列问题:
(1)写出D基态原子的电子排布式 ;
(2)A的常见氢化物AH3 的VSEPR模型为
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ,X是一种超硬物质,耐磨损、抗腐蚀能力强,
推测X的晶体类型为 。
(4)E的最高价氧化物的结构式为 中心原子的杂化方式为 。
(5)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 。
(6)TiO2的天然晶体中,最稳定的一种晶体结构如下图,黑球表示 原子。
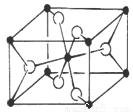
(7)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物,该化合物中Fe2+与环戊二烯基离子之间以 (填“离子键”、“金属键”、“配位键”、“氢键”、“范德华力”)相结合。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
下列有关化学用语表示错误的是
A.HCN的结构式:H-C≡N
B.HClO的电子式为: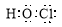
C.HOCH2COOH缩聚物的结构简式:
D.2-氯甲苯的结构简式: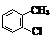
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com