
分析 (1)元素就是具有相同的核电荷数(即核内质子数)的一类原子的总称;核素是指具有一定数目质子和一定数目中子的一种原子;具有相同质子数,不同中子数同一元素的不同核素互为同位素;
(2)原子符号左上角的数字为质量数;
(3)根据氢原子有三种同位素和氯原子有两种同位素,它们两两结合生成氯化氢进行判断.
解答 解:(1)元素的种类由质子数决定,质子数不同,元素的种类就不同,1H、2H、3H、1H+;234U、235U、238U;40K;40Ca;Cl2;14N;14C分别属于H;U;K;Ca;Cl;N;C7种元素,氢元素的核素有3种1H、2H、3H,1H、2H、3H互为同位素,234U、235U、238U互为同位素,
故答案为:7;3;1H、2H、3H;234U、235U、238U;
(2)1H、1H+的质量数都是1,40K、40Ca的质量数都是40,14N、14C的质量数都是14,所以质量数相等的粒子为以上三组,
故答案为:1H、1H+;40K、40Ca;14N、14C;
(3)氢原子有三种同位素H、D、T,氯原子有两种同位素35Cl、37Cl,故氯化氢分子可能为:H35Cl、H37Cl、D35Cl、D37Cl、T35Cl、T37Cl,则形成的氯化氢分子的种类有6种,
故答案为:6.
点评 本题主要考查了核数的种类、元素的种类、同位素的概念以及氢原子的三种同位素和氯原子的两种同位素的组合,题目难度中等,要注意平时的积累,氢原子的三种同位素和氯原子的两种同位素的组合为该题易错点.


科目:高中化学 来源: 题型:选择题
| A. | 粒子半径:Al3+>Mg2+>F- | B. | 热稳定性:HI>HBr>HCl>HF | ||
| C. | 酸性:H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3>Mg(OH)2>NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
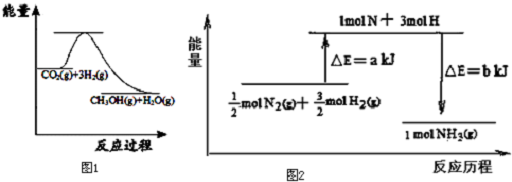
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

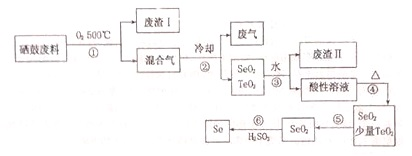
| 物理性质 | 熔点 | 沸点 | 升华 | 溶解性 |
| SeO2 | 340℃ | 684℃ | 315℃ | 易溶于水 |
| TeO2 | 733℃ | 1260℃ | 450℃ | 易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在离子化合物中也可能存在共价键 | |
| B. | 非金属元素之间的化学键不一定是共价键 | |
| C. | 含离子键的化合物一定是离子化合物 | |
| D. | 含共价键的纯净物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)<10 mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(HC2O4-)>c(C2O42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.04L | B. | 6.72L | C. | 20.16L | D. | 40.32L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择.
煤、天然气、石油综合利用是构建节约型、环境友好型社会的必然选择. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com