
蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名。蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成。工业上由蛇纹石制取碱式碳酸镁产品的流程如下:

(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是________。
(2)向Ⅰ中加入H2O2的作用是 ,有关离子方程式 ,加入Ca(OH)2时, 需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表)。
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 1.5 | 3.3 | 9.4 |
若pH>8可能导致的后果 。
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入 溶液,然后过滤、洗涤、 _________(填写实验操作名称),即可获得红色颜料,实现废物的综合利用。
(4)若产品的化学式用aMgCO3·bMg(OH)2·cH2O表示,现称取18.2 g产品并使之完全分解,收集到3.36L CO2(标准状况下)和8.0 g MgO,通过计算确定产品的化学式中:a=________,b=________,c=________。
(1)Fe2+、Fe3+
(2)将Fe2+氧化为Fe3+; ;Al(OH)3溶解;Mg2+沉淀
;Al(OH)3溶解;Mg2+沉淀
(3)NaOH溶液
(4)3;1;3
【解析】
试题分析:(1)蛇纹石矿可以看做MgO、FeO、Fe2O3、Al2O3、SiO2组成,蛇纹石加盐酸溶解后,MgO、FeO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解,故溶液里除了Mg2+、Al3+外,还含有Fe2+、Fe3+;(2)由(1)知,此时溶液中除了Mg2+外,还含有Fe3+、Fe2+、Al3+杂质,需除去,故向Ⅰ中加入H2O2的作用是将Fe2+氧化为Fe3+然后除去,因Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,利用平衡移动的原理,消耗H+使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,加Ca(OH)2需将溶液的pH控制在7~8,若pH过高,会导致生成的Al(OH)3发生反应Al(OH)3+OH-=AlO2-+2H2O溶解,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀,同时Mg2+也因转化为沉淀而损失。(3)从实验步骤图知:沉淀混合物为Fe(OH)3和Al(OH)3,红色氧化物是沉淀物Fe(OH)3分解后得到的Fe2O3,所以得先加碱把Al(OH)3除掉,反应为:Al(OH)3+NaOH=NaAlO2+2H2O,然后过滤洗涤灼烧即可。(4)m(样品)=18.2g,n(CO2)=0.15mol,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分【解析】
aMgCO3?bMg(OH)2?cH2O  (a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得a:b:c=0.15:0.05:0.15=3:1:3。
(a+b)MgO+aCO2↑+(b+c)H2O↑,根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,则m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得a:b:c=0.15:0.05:0.15=3:1:3。
考点:考查铁、铝、硅等化合物的性质及化学式计算等内容。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2013-2014重庆市万州区高三考前模拟理综化学化学试卷(解析版) 题型:选择题
某小分子抗癌药物的分子结构如图所示,下列说法正确的是
A.1mol该有机物最多可以和5mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:实验题
【选修2-化学与技术】(15分)
“烂版液”是制印刷锌板时,用稀硝酸腐蚀锌板后得到的“废液”(含有少量的Cl-、Fe3+),某化学兴趣小组拟用“烂版液”制取Zn(NO3)2·6H2O的过程如下:

已知:Zn(NO3)2·6H2O是一种无色晶体,水溶液呈酸性,Zn(NO3)2能与碱反应,得到的产物具有两性。
(1)“烂版液”中溶质的主要成分是________(填化学式),若稀硝酸腐蚀锌板产生的气体为N2O,写出稀硝酸腐蚀锌板反应的主要化学方程式______________________。
(2)在操作①中保持pH=8的目的是_________________________________。
(3)沉淀Ⅰ的主要成分是___________________________________________。
(4)操作③中加热、煮沸的目的是___________。此步骤操作的理论依据是_______________。
(5)操作④保持pH=2的目的是_______。此步骤操作中所用的主要仪器是_____ ______。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3-
B.0.1mol·L-1Ca(ClO)2溶液:K+、Na+、I-、Cl-
C.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3-
D.加入KSCN显红色的溶液:Na+、Mg2+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:填空题
对某芳香烃A分析结果如下:质谱图显示其最大质荷比为120,红外光谱显示其有两个甲基,核磁共振氢谱显示有五种峰且其面积比为1:2:2:1:6,A在有机合成中能发生如下转化:

(已知:烃基发生取代反应的活性次序为 CH > CH2 > CH3 即叔氢>仲氢>伯氢)
回答以下问题:
(1)写出A的结构简式 ;
(2) 反应①和②相同的反应试剂和条件为 ;
(3)F分子中的含氧官能团名称是 ;
(4)反应③的化学方程式为: ;
(5)写出满足下列条件的H分子的所有同分异构体的结构简式:
①含有苯环 ②1 mol有机物发生银镜反应生成4 mol Ag ③苯环上的一溴代物有两种
;
(6)与H具有相同官能团的H的同分异构体有四种,其中一种分子K还存在顺反异构
体,试写出K的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:选择题
常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4Cl溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(Cl-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:填空题
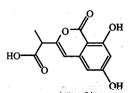
(6分)苹果酸结构如下,常用做汽水、糖果的添加剂。

试写出苹果酸分别与下列物质反应的化学方程式:
(1)与Na 。
(2)与Na2CO3 __________________________。
(3)与CH3CH2OH按物质的量比1∶2反应(浓H2SO4,△)_________ __ 。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省五校第二学期期末联考高一化学试卷(解析版) 题型:选择题
下列用水就能鉴别的一组物质是
A.苯、己烷、四氯化碳 B.苯、乙醇、四氯化碳
C.硝基苯、乙醇、四氯化碳 D.硝基苯、乙醇、乙酸
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省福州八县高二下学期期末考试化学试卷(解析版) 题型:填空题
(12分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a |
|
| |||||||||||||||
b |
|
|
| c | d | e | f |
| |||||||||
g | h | i | j |
| k | l | m | ||||||||||
n |
|
|
|
|
| o | p |
|
|
|
|
|
|
|
|
|
|
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子外围电子排布式: 。
(2)c与a形成6个原子组成分子结构简式: ,
该分子是: (填“极性”或“非极性”)分子。
(3)表中O、P两元素的部分电离能数据列于下表:
元 素 | O | P | |
电离能 kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态O2+再失去一个电子比气态P2+再失去一个电子难。对此,你的解释是 ;
(4)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

晶胞中i原子的配位数为 ,一个晶胞中i原子的数目为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com