
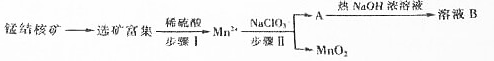
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
分析 工业上从锰结核中制取纯净的MnO2工艺流程中,先选矿富集,锰结核为锰的氧化物与其它金属氧化物的混合物,加入稀硫酸和试剂甲发生反应生成Mn2+,说明发生了氧化还原反应生成锰离子,则甲为还原剂,在溶液中加入NaClO3反应生成MnO2、水和气体A等,A和热氢氧化钠溶液反应生成溶液B,溶液B中的产物之一(Q)可循环用于上述生产证明Q为NaClO3,则A为Cl2,B为氯化钠、氯酸钠的溶液,二氧化锰不溶于水,得到MnO2.
(1)0.1mol/L的NaClO3溶液200ml的物质的量是0.02mol,当消耗0.05molMn2+时,转移电子的物质的量是0.05mol×(4-2)=0.1mol,根据电子得失守恒可知0.02mol氯酸钠得到0.1mol电子,因此氯元素的化合价变化5价,即从+5价降低到0价,因此还原产物是氯气;
(2)氯气与热的氢氧化钠溶液反应生成氯酸钠、氯化钠和水;
(3)根据原电池工作原理判断正极发生还原反应,然后根据总反应写出正极的电极反应式;根据Q=It,计算出电子转移的数目,再结合电子守恒计算消耗的Zn的质量;
(4)根据反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4,据此书写;结合实验室利用MnO2和浓盐酸反应制氯气来检验黑色固体是否是二氧化锰;
(5)根据Fe(OH)3溶度积常数计算Fe3+离子浓度等于1×10-5mol•L-1时,溶液中OH-浓度,再计算溶液的pH;同样根据根据Zn(OH)2溶度积常数计算Zn2+浓度为0.1mol•L-1时,溶液中OH-浓度,再计算溶液的pH;如果不将Fe2+氧化成Fe3+,则可结合溶度积常数判断当Zn2+沉淀时,Fe2+是否沉淀,对产物的纯度有无影响.
解答 解:工业上从锰结核中制取纯净的MnO2工艺流程中,先选矿富集,锰结核为锰的氧化物与其它金属氧化物的混合物,加入稀硫酸和试剂甲发生反应生成Mn2+,说明发生了氧化还原反应生成锰离子,则甲为还原剂,在溶液中加入NaClO3反应生成MnO2、水和气体A等,A和热氢氧化钠溶液反应生成溶液B,溶液B中的产物之一(Q)可循环用于上述生产证明Q为NaClO3,则A为Cl2,B为氯化钠、氯酸钠的溶液,二氧化锰不溶于水,得到MnO2.
(1)0.1mol/L的NaClO3溶液200ml的物质的量是0.02mol,当生成0.05molMnO2时,转移电子的物质的量是0.05mol×(4-2)=0.1mol,根据电子得失守恒可知0.02mol氯酸钠得到0.1mol电子,因此氯元素的化合价变化5价,即从+5价降低到0价,因此还原产物是氯气,所以该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑,
故答案为:2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑;
(2)氯气与热的氢氧化钠溶液反应生成氯酸钠、氯化钠和水,因此可以循环的物质B是氯酸钠,
故答案为:氯酸钠;
(3)原电池中负极失去电子,正极得到电子,因此碱性锌锰电池放电时,正极是二氧化锰得到电子,则电极反应式为:MnO2+H2O+e-=MnO(OH)+OH-;5分钟转移电子的电量Q=It=5A×300s=1500C,转移电子的物质的量为$\frac{Q}{F}$=$\frac{1500C}{96500C/mol}$≈0.0155mol,则消耗的Zn的质量为$\frac{0.0155mol}{2}$×65g/mol=0.5g,
故答案为:MnO2+H2O+e-═MnOOH+OH-;0.5;
(4)因为反应物有稀草酸,产物有二氧化碳,则说明碳元素化合价升高发生氧化还原反应,所以锰化合价降低生成二价的MnSO4,方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;根据实验室制氯气的反应原理,取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2,
故答案为:2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O;取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2;
(5)铁加入稀H2SO4和H2O2,可被氧化生成Fe3+,铁刚好沉淀完全时离子浓度小于1×10-5mol•L-1,因Ksp=10-39,
则c(OH-)=$\root{3}{\frac{1{0}^{-39}}{1×1{0}^{-5}}}$mol/L≈0.5×10-11mol/L,此时pH=2.7,
如锌开始沉淀,则c(OH-)=$\sqrt{\frac{1{0}^{-17}}{0.1}}$mol/L=10-8mol/L,此时pH=6,
由表中数据可知Zn(OH)2、Fe(OH)2的Ksp相近,如不加H2O2,则Zn2+和Fe2+分离不开,
故答案为:2.7;6;Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开.
点评 本题考查内容较多,设计氧化还原反应的原理与应用、离子方程式的书写、溶度积常数及计算、制备实验方案的设计等知识,侧重于学生的分析能力和实验能力的考查,为高考常见题型,注意相关知识的学习与积累,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
下列分散系中分散质粒子最小的是
A.葡萄糖溶液 B.Fe(OH)3胶体 C.少量植物油和水混合 D.泥水
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$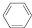 (g)+3H2(g).
(g)+3H2(g).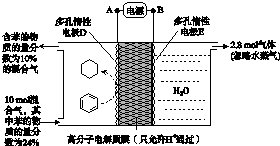
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
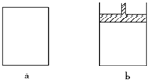 有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:
有a、b两个极易导热的密闭容器,a保持容积不变,b中的活塞可上下移动,以保持内外压强相等.在相同条件下将3molA、1molB分别同时混合于a、b两容器中,发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
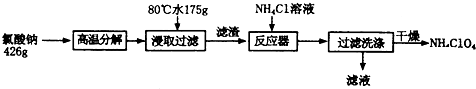
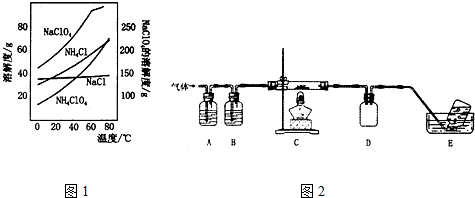
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

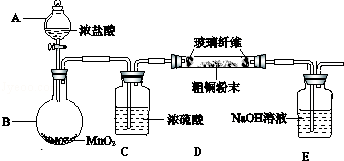
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com