
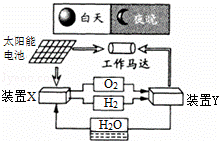
如图是一种航天器能量储存系统原理示意图.下列说法正确的是( )
|
| A. | 该系统中只存在3种形式的能量转化 |
|
| B. | 装置Y中电能转化为化学能 |
|
| C. | 装置X能实现燃料电池的燃料和氧化剂再生 |
|
| D. | 装置X、Y形成的子系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
| 原电池和电解池的工作原理. | |
| 专题: | 电化学专题. |
| 分析: | A.该系统中存在光能、电能、化学能以及机械能的转化; B.装置Y为原电池装置,化学能转化为电能; C.装置X为电解池,电解生成氧气和氢气; D.化学能与电能间不可能完全转化. |
| 解答: | 解:A.系统中存在光能﹣→电能、电能﹣→化学能、化学能﹣→电能、电能﹣→机械能等多种能量转化方式,故A错误; B.装置Y为原电池装置,化学能转化为电能,故B错误; C.装置X可电解水生成H2和O2,能实现燃料电池的燃料和氧化剂再生,故C正确; D.无论是原电池还是电解池都不可能实现电能与化学能的完全转化,故D错误. 故选C. |
| 点评: | 本题综合考查电解池和原电池知识,难度不大,侧重于电池工作原理的考查,注意能量转化形式以及电极方程式的书写. |


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
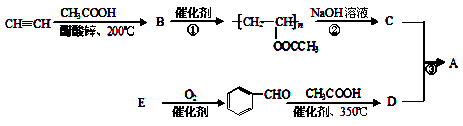
聚乙烯醇肉桂酸酯(A)可用于光刻工艺中做抗腐蚀涂层。下面是一种合成该有机物的路线:
已知: 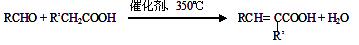
请回答:
(1)反应①是加聚反应,B的结构简式是 。B中的官能团的名称为
(2)反应②的反应方程式是 ;反应类型是 。
(3)E的分子式为C7H8O,E的名称是 ,其中符合下列条件的E的同分异构体的结构简式是 。
① 能与浓溴水反应产生白色沉淀 ②核磁共振氢谱有4种峰
(4)  能发生银镜反应,该反应的化学方程式是 。
能发生银镜反应,该反应的化学方程式是 。
(5)A的结构简式是 ,关于A的性质下列说法正确的是 (填字母)。
a.存在顺反异构
b.是通过加聚反应生成
c.能使KMnO4(H+)溶液和Br2(CCl4)溶液褪色
d.能发生取代反应、氧化反应、还原反应、加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
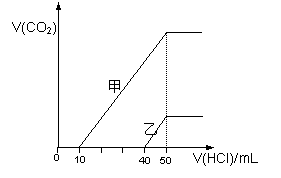
向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙;向甲、乙两溶液中分别滴加0.1mol·L-1盐酸,此时反应生成CO2体积(标准状况) 与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
A.乙溶液中滴加盐酸后产生CO2体积的最大值为112mL(标准状况)
B.当0<V(HCl)<10mL时,甲溶液中发生反应的离子
方程式为: OH-+H+→H2O
C.乙溶液中含有的溶质是NaOH、NaHCO3
D. 原NaOH溶液的物质的量浓度为0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成
B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成
C.加入适量NaOH,溶液中离子浓度为[CH3COO-]>[Na+]>[OH-]>[H+]
D.加入适量氨水,[CH3COO-]一定大于[Na+]、[NH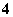 ]之和
]之和
查看答案和解析>>
科目:高中化学 来源: 题型:
化学知识在生产、生活中有着广泛的应用.下列说法中不正确的是( )
A. 用植物秸秆、动物粪便等生产的沼气是一种清洁的能源
B. 手机上用的锂离子电池属于二次电池
C. 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化
D. 研制开发燃料电池汽车,可有效降低机动车尾气污染
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某未知溶液中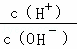 =1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检 验就能加以否定的离子是( )
=1×1012,且含有大量Al3+和NO3﹣,检验此溶液中是否大量存在以下6种离子:①SiO32﹣、②NH4+、③Fe2+、④Na+、⑤HCO3﹣、⑥Cl﹣,其中不必检 验就能加以否定的离子是( )
|
| A. | ①③⑤ | B. | ②③④ | C. | ①②⑥ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
镁是一种重要的金属资源,工业上制取镁单质主要是电解法.
(1)电解法制取镁单质的反应方程式是: .
(2)电解原料无水氯化镁可由海水制备.主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩冷却结晶.
其步骤先后顺序是 ;(每步骤可重复使用)
(3)上述步骤①中“一定条件下”具体是指: ,其目的是 .
(4)已知某温度下Mg(OH)2的Ksp=6.4×l0﹣12,当溶液中c(Mg2+)≤1.0×10﹣5mol•L﹣1可视为沉淀完全,则此温度下应保持溶液中c(OH﹣)≥ mol•L﹣1.
(5)饱和NH4Cl溶液滴入少量的Mg(OH)2悬浊液中,看到的现象是 .反应原理可能有两方面,请分别用离子方程式表示:① ;② .
要验证①②谁是Mg(OH)2溶解的主要原因,可选取 代替NH4Cl溶液作对照实验.
A.NH4NO3 B.(NH4)2SO4 C.CH3COONH4 D.NH4HCO3
(6)镁电池是近年来科学技术研究的热点之一.一种“镁﹣次氯酸盐”电池的总反应为:
Mg+ClO﹣+H2O═Mg(OH)2+Cl﹣.其工作时正极的电极反应式: ClO﹣+2e﹣+H2O=Cl﹣+2OH﹣ ;用此镁电池给铅蓄电池充电,下列说法中正确的是 .
A.镁电池正极与铅蓄电池正极相连
B.电子从Pb电极转移到镁电池负极
C.充电后,铅蓄电池两极质量均减小,理论上镁电池消耗24g Mg,阴、阳极的质量变化之比为3:2
D.充电后,镁电池和铅蓄电池的pH均增大.
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,将0.01 mol CH3COONa和0.002 mol HCl溶于水,形成1 L溶液。
(1)该溶液中共含有______种不同的微粒(包括分子和离子)。
(2)在这些微粒中,________和________两种微粒的物质的量之和等于0.01 mol。
(3)________和________两种微粒的物质的量之和比H+的物质的量多0.008 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B和C的物质的量分别为4 mol、2 mol和4 mol。保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )
A.均减半 B.均加倍
C.均增加1 mol D.均减少1 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com