利用可再生能源代替石油和煤已经成为未来发展的趋势,甲醇作为重要的可再生能源具有广泛的开发和应用前景.工业上常利用反应CO(g)+2H
2(g)?CH
3OH(g)△H<0来合成甲醇.
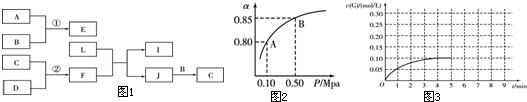
(1)经研究发现在230℃~270℃时合成最为有利.为探寻合成气最合适的起始组成比,分别在230℃、250℃和270℃时进行实验,实验结果如图1.230℃的实验结果所对应的曲线是
(填字母); 从提高CO转化率的角度等综合分析,该温度下工业生产适宜采用的合成气组成n(H
2):n(CO) 的比值范围是
(填字母).
A.1~1.5 B.2.5~3 C.3.5~4.5
(2)制甲醇所需要的氢气,可通过下列反应制取:H
2O(g)+CO(g)?H
2(g)+CO
2(g)
△H<0,某温度下该反应的平衡常数K=1.回答下列问题:
①该温度下,若起始时c(CO)=2mol?L
-1,c(H
2O)=3mol?L
-1,反应进行一段时间后,测得CO的浓度为1mol?L
-1,则此时该反应v(正)
v(逆)(填“>”、“<”或“=”).
②若降低温度,该反应的K值将
(填“增大”、“减小”或“不变”).
(3)甲醇是一种化工原料,工业上合成甲醇的反应:CO(g)+2H
2(g)?CH
3OH(g)△H=-90.8kJ?mol
-1.
若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO、2molH2 |
1mol CH3OH |
2molCO、4molH2 |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
①容器内压强P:P
甲、P
乙与P
丙的关系是
(用“>”、“<”或“=”表示);
②变化的热量数值Q中,Q
1 与Q
2的和是
(填具体数值).
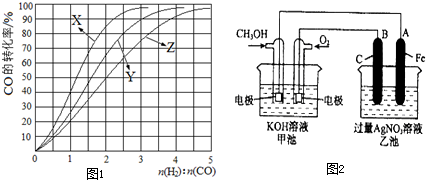
(4)目前,以甲醇为原料的燃料电池已经应用于工业生产.下图是甲醇燃料电池应用的示意图2,已知甲池的总反应式为:2CH
3OH+3O
2+4KOH=2K
2CO
3+6H
2O请根据图2填写下列空白:乙池中A电极的电极反应式为
,甲池中通入CH
3OH电极的电极反应式为
.

 ,
, ;
; ;
; ;
;