
【题目】硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见下图)。下列说法正确的是
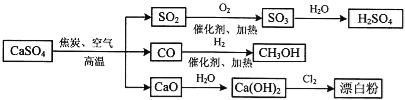
A.CO、SO2、SO3均是酸性氧化物
B.工业上利用Cl2和澄清石灰水反应来制取漂白粉
C.除去与水反应,图示转化反应均为氧化还原反应
D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100%
科目:高中化学 来源: 题型:
【题目】下列实验能达到实验目的的是( )
实验目的 | 实验操作 | |
A | 比较S和Si的非金属性强弱 | 向Na2SiO3溶液中通入SO2产生白色沉淀 |
B | 除去NaHCO3溶液中的杂质Na2CO3 | 向混合液中通入足量的CO2气体 |
C | 检验某盐是否为铵盐 | 试样 |
D | 验证H2O2和Fe3+的氧化性 强弱 | 将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种常见的化工原料。查阅资料知:苯和液溴在溴化铁(FeBr3)存在的条件下可发生反应生成溴苯,此反应为放热反应。实验室合成溴苯的装置示意图及有关数据如下。先向A中加入16.0mL的无水苯和5.0mL液溴,再将混合液慢慢滴入反应器B中。请回答下列问题:
苯 | 溴 | 溴苯 | |
相对分子质量 | 78 | 160 | 157 |
颜色状态 | 无色液体 | 深红棕色液体 | 无色液体 |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中的溶解性 | 难溶 | 微溶 | 难溶 |
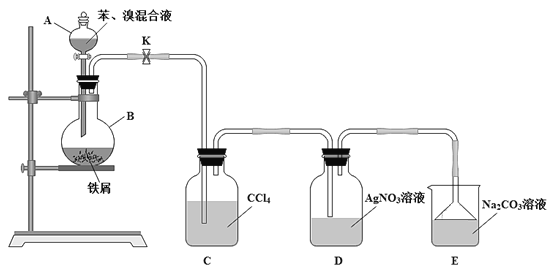
(1)仪器A的名称为____。
(2)反应器B中发生的主要有机反应的化学方程式是___。
(3)下列关于该实验操作或叙述错误的是___(填字母序号)。
a.向反应器B中滴加苯和溴的混合液前需先关闭K
b.实验中装置C中的液体逐渐变为浅红色
c.实验中装置D中的导管口附近有白雾产生,溶液中产生淡黄色的沉淀,根据该现象说明苯和液溴发生的反应为加成反应
d.装置D中的导管不能插入液面以下和装置E中导管末端连接倒扣着的漏斗都是为了防倒吸
e.溴苯不能与AgNO3溶液反应产生淡黄色沉淀
(4)实验完毕待冷却后,经过下列步骤对溴苯进行分离提纯:
①向B中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。用NaOH溶液洗涤的作用是___;
③向分离出的粗溴苯中加入少量的无水氯化钙,静置、过滤。
(5)经过上述分离操作后,粗溴苯中还含有的主要杂质为__,要进一步提纯,下列操作中必须的是___。
a.萃取 b.蒸馏 c.重结晶 d.过滤 e.分液
(6)若经过上述分离提纯的操作,经进一步精制得到6.2mL的溴苯,则该实验中溴苯的产率是___(计算结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿是铁和钛的氧化物矿物,成分可表示为FeTiO3(Ti为+4价)。钛白粉(TiO2)涂料、塑料、油墨、造纸行业具有广泛的用途,制备流程如图:

(1)钛铁矿与硫酸反应时可表示为FeTiO3+H2SO4→TiOSO4+X+H2O,其中X的化学式为 ______,该反应为______ (填“氧化还原反应”或“非氧化还原反应”)。
(2)某钛铁矿中FeTiO3的含量为76%,该钛铁矿与硫酸反应时Ti转化率为92%,操作I到操作IV的过程中Ti的转化率为96%,则1t该钛铁矿可生产钛白粉 ______ t(所有计算结果保留两位有效数字),能否计算绿矾的产量______?(若能则计算数值,否则说明理由)。
(3)操作I的名称是 ______,操作II包括搅拌、结晶、______,操作II中加入铁粉的目的是______(用离子方程式表示)。
(4)写出操作III中TiOSO4水解的化学方程式: ______ 。
(5)该生产过程中产生的尾气SO2、SO3的处理方法是 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁合金作为钢的添加料生产多种具有高强度、耐高温、耐腐蚀等优良性能的特种钢,这类特种钢中含有碳、硅、氧、氮、磷等元素。
(1)基态Cr原子的价电子排布式为___。
(2)C、N、O三种元素的第一电离能由大到小的顺序为___。
(3)PO43-的空间构型为___,中心原子的杂化方式为___。
(4)无水CrCl3和氨分子作用能形成某种配合物,该配合物的组成相当于CrCl3·6NH3。已知:若加入AgNO3溶液,能从该配合物的水溶液中将所有的氯沉淀为AgCl;若加入NaOH溶液并加热,无刺激性气体产生。请从配合物的形式推算出它的内界和外界,写出该配合物的结构式__,1mol该配合物中含有σ键的数目为__。
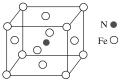
(5)铁和氮形成一种晶体,晶胞结构如图所示,则该晶体的化学式为___,若该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的体积是__cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数值,下列说法正确的是( )
A.46gNO2和N2O4混合气体中含有原子数为3.5NA
B.50g质量分数为46%的乙醇水溶液中氧原子数为2NA
C.用惰性电极电解H2SO4溶液,若阳极产生5.6L气体,则电路中通过0.5NA电子
D.常温下,1LpH=3的醋酸溶液稀释到10L时,溶液中H+的数目大于0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。四种元素形成的单质依次为m、n、p、q; r、t、u是这些元素组成的二元化合物,其中u为葡萄酒中抑菌成分;25℃时,0.01mol/L的v溶液中: =1.0×10-10。上述物质的转化关系如图所示。下列说法正确的是( )
=1.0×10-10。上述物质的转化关系如图所示。下列说法正确的是( )

A.原子半径的大小:X<Y<Z<W
B.元素的非金属性:Y>W>X
C.t中只含离子键
D.v能抑制水的电离而u能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 | 部分实验现象 |
| a极质量减小,b极质量增加 |
| b极有气体产生,c极无变化 |
| d极溶解,c极有气体产生 |
| 电流计指示在导线中电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将铜粉加入1.0mol/LFe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
B | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 熔化后的液态铝不滴落下来 | 氧化铝的熔点高于铝的熔点 |
C | 常温下,用pH计测0.1mol/LNaX溶液和0.1mol/LNa2CO3溶液的pH | 前者小于后者 | 酸性:HX>H2CO3 |
D | 向10%的蔗糖溶液中加入少量稀硫酸,水浴加热一段时间,再加入银氨溶液 | 未出现光亮银镜 | 蔗糖未发生水解 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com